-
ICU中G+球菌是重症感染常见病原微生物之一[1],与病死率及病人预后密切相关[2]。临床上万古霉素常用于治疗G+球菌感染,疗效可靠。确诊G+球菌感染,需要通过培养结果获得,易受多种因素影响,需要2~3 d以上,容易延误重症病人使用抗生素,因此,难以满足指导抗生素选择的需求,对于重症感染的抗生素选择,临床上多根据痰液或各种分泌物性状、影像学资料等经验性抗G+球菌治疗,但经验性与非经验性治疗对疗效及预后的影响仍存在争议[3-4],我们通过以下研究,观察经验性和非经验性使用万古霉素抗G+球菌治疗对病人疗效、不良反应及预后的影响。现作报道。
-
选择2015年7月至2018年1月在蚌埠医学院第一附属医院ICU住院并使用万古霉素治疗的重症感染病人,包括脓毒症、多发伤和脑出血病人。
-
按照有无确定G+球菌感染证据分为2组,分别为:通过症状经验治疗的病人39例,设为E组;有确切病原学培养证实为G+球菌感染的病人21例,设为P组。E组为经验治疗组:根据病人痰液性状、影像学及抗G-杆菌效果不佳等判断,由两位副主任医师以上职称做出决定。P组为确诊用药非经验治疗组:根据痰培养或痰涂片结果,由一位副高以上职称做出决定。
-
(1) 临床指标:年龄、性别、体质量等资料,以及化验室检查、急性生理学评分(APACHEⅡ)和格拉斯哥昏迷量表评分(GCS)、是否接受手术、机械通气和时间、感染部位以及合并使用抗生素;(2)所有病人均使用万古霉素治疗(1.0 g,12 h 1次)。第5次输注万古霉素前抽取外周血谷浓度;(3)疗效和预后观察:谷浓度及区间、7 d感染控制数、使用万古霉素72 h后的体温和白细胞、肾功能、ICU住院时间、28 d生存率。
-
采用t检验、秩和检验、χ2检验和logistic回归分析。
-
共纳入60例病人,通过症状经验治疗的E组病人共39例,有病原学培养证据证实G+球菌感染的P组病人共21例,2组年龄等一般资料、实验室检查、GCS评分、APACHEⅡ评分、接受手术例数、机械通气情况、感染部位及抗生素使用种类差异均无统计学意义(P>0.05)(见表 1)。
一般资料 E组(n=39) P组(n=21) uc P 年龄/岁 50.64±16.95 51.43±13.38 0.18* >0.05 性别(男) 29 15 0.06# >0.05 体质量/kg 62.0(55.0, 69.0) 70.0(58.5, 73.5) 1.70 >0.05 抗感染前体温/℃ 39.10(39.00, 39.50) 39.00(38.35, 39.40) 1.61 >0.05 抗感染前白细胞/(×109) 12.81(10.57, 20.15) 12.15(10.65, 17.90) 0.26 >0.05 抗感染前肌酐/(μmol/L) 62.00(49.00, 80.00) 73.00(56.00, 91.00) 1.32 >0.05 抗感染前尿素氮/(mmol/L) 6.50(4.49, 9.20) 7.08(4.66, 9.27) 0.35 >0.05 白蛋白/(g/L) 35.39±4.87 35.59±5.24 0.15* >0.05 GCS评分/分 7.00(5.00, 15.00) 10.50(5.25, 15.00) 0.98 >0.05 APACHEⅡ评分/分 20.21±5.65 18.71±7.04 0.90* >0.05 接受手术病人/例 31 17 0.02# >0.05 接受机械通气/例 30 17 0.013# >0.05 机械通气时间/h 143.00(71.00, 245.00) 72.00(35.50, 234.50) 1.26 >0.05 感染部位/例 颅内 18 10 0.01# >0.05 肺部 37 20 0.00# >0.05 腹腔 4 1 0.54# >0.05 血流 6 7 2.59# >0.05 合并使用抗生素/例 碳氢酶烯类 28 11 2.26# >0.05 β-内酰胺类 18 10 0.01# >0.05 喹诺酮 7 4 0.01# >0.05 *示t值;#示χ2值 表 1 一般资料比较
-
wE组和P组的谷浓度以及区间、72 h后白细胞和7 d感染控制方面差异均无统计学意义(P>0.05),但使用万古霉素72 h后的体温差异有统计学意义(P < 0.05)(见表 2)。
分组 n 万古霉素谷浓度/(mcg/mL) 谷浓度区间例/(mcg/mL) 7 d临床感染
治愈/例使用72h后
体温/℃使用72 h后
白细胞/×1090~10 10~20 >20 E组 39 9.70(5.40, 19.80) 20 10 9 27 38.57±0.65 12.38(9.73, 16.86) P组 21 9.30(5.30, 16.00) 11 7 3 16 38.14±0.73* 11.13(8.00, 16.26) uc — 0.4 0.82# 0.33 2.34 0.62 P — >0.05 >0.05 >0.05 0.022 >0.05 *示t值;#示χ2值 表 2 2组谷浓度和疗效的比较
-
E组和P组的肾功能及ICU住院时间差异无统计学意义(P>0.05),但28d生存率差异有统计学意义(P < 0.05)(见表 3)。
分组 n 停万古霉素
肌酐/(μmol/L)停万古霉素
尿素氮/(mmol/L)28 d生存
例数/例ICU住院
时间/dE组 39 51.00(38.50, 69.00) 6.71(3.86, 9.37) 14 16.00(10.00, 24.00) P组 21 62.00(52.50, 102.25) 5.13(3.99, 10.23) 2 18.00(11.00, 27.00) uc — 0.41 -0.08 4.86# 0.85 P — >0.05 >0.05 < 0.05 >0.05 *示t值;#示χ2值 表 3 2组预后指标比较
-
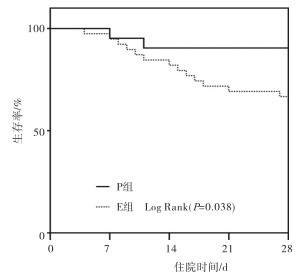
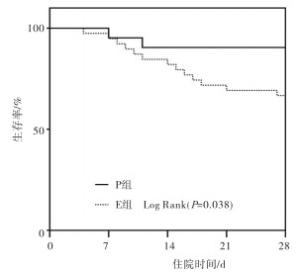
Kaplan-Meier生存分析显示,E组的生存率低于P组(P < 0.05)(见图 1)。
-
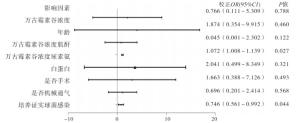
使用logistics多因素分析发现稳态谷浓度时尿素氮和病原学确诊G+球菌与病人预后有关(P < 0.05)(见图 2、表 4)。
影响因素 OR(95%CI) 校正OR(95%CI) P 万古霉素谷浓度 0.974(0.808~1.176) 0.766(0.111~5.309) >0.05 年龄 1.041(0.936~1.158) 1.874(0.354~9.915) >0.05 万古霉素谷浓度肌酐 0.930(0.848~1.020) 0.045(0.001~2.302) >0.05 万古霉素谷浓度尿素氮 3.960(1.170~13.400) 1.072(1.008~1.139) < 0.05 白蛋白 1, 155(0.869~1.534) 2.041(0.499~8.349) >0.05 是否手术 1.118(0.812~1.541) 1.663(0.388~7.126) >0.05 是否机械通气 0.914(0.672~1.244) 0.696(0.201~2.414) >0.05 培养证实球菌感染 0.941(0.887~0.998) 0.746(0.561~0.992) < 0.05 表 4 临床因素与死亡相关分析
-
ICU主要收治病情危重的病人,部分病人存在免疫力低下,并且住院期间侵入性操作较多,可导致感染的发生,其中G+球菌是常见的多重耐药菌[2, 5],此类细菌感染ICU病人具有高发病率和高病死率的特点[6],故抗感染治疗成为重点。万古霉素作为在ICU治疗多重耐药的G+球菌的常用药物具有疗效较好,与其他类型抗生素无交叉耐药性等特点[7]。
众所周知,ICU中经常长期使用万古霉素是导致其耐药的原因之一。临床上,G+球菌感染的确诊是病原菌培养证实,但培养回报的结果速度慢,阳性率低,这使得临床医生需要凭临床经验,通过间接证据,如痰液性状、流行病学特点及影像学特征,经验性使用万古霉素抗G+球菌治疗的现象。此研究中纳入60例重症病人接受万古霉素治疗,其中经验性抗G+球菌占65%,确诊后抗G+球菌仅占35%。此结果说明ICU中经验性抗G+球菌治疗是比较普遍现象,也是临床一线医生较为接受的诊治过程。
ICU中病人因病情复杂、危重,没有足够时间等待培养结果,指导抗生素选择,故经验性抗生素治疗能帮助病人快速抑制病情的发展,减少感染相关的并发症发生,在ICU中存在“强力+广覆盖经验性抗生素治疗”理念。与之相反,有文献报道经验性不当选择抗生素可以增加死亡率[8],本研究与之结果相同,即E组的28 d死亡率明显高于P组,说明没有确诊经验性抗G+球菌治疗可能导致菌群失调、抗菌失败等不良反应,不利于28 d生存率的改善,另外logistics多因素分析得出培养证实球菌感染是病人死亡风险之一。同时,证据不足使用抗G+球菌,对于感染控制不佳,尤其体现在体温的控制方面,本研究发现E组使用万古霉素72 h后体温明显高于P组,但白细胞变化差异,此原因我们认为白细胞升高与炎症反应有关系,在重症病人中影响炎症反应除了感染,还有许多其他因素,比如各种应激等。
万古霉素主要不良反应为肾功能损害[9],本研究中观察了使用万古霉素后的肾功能变化,P组和E组无差异,证明经验性和确诊后使用万古霉素并不影响副作用的发生,但后续logistic多因素分析发现谷浓度时的尿素氮和病人死亡风险相关,可能提示病人肾功能差,尿素氮升高往往提示病人预后不佳,这与FENG等[10]的研究相似,尿素氮也是重症感染病人死亡的重要预测因子。万古霉素推荐剂量是基于该药稳态外周血谷浓度5~10 mcg/mL,但考虑重症病人病情危重且复杂,故文献建议将浓度提高到10~20 mcg/mL[11],本研究显示2组万古霉素稳态谷浓度及区间并无差异,我们认为谷浓度与给药剂量和输注方式有关,与是否经验性用药无关。
本研究不建议经验性抗G+球菌治疗,可能与增加重症感染病人28 d死亡率有关,建议有确诊证据情况下使用万古霉素抗G+球菌治疗。并且建议规范使用万古霉素,检测其血药浓度,对于有慢性肾功能不全病人,有文献报道使用群药代动力学分析监测给药可以更加安全快速的达到有效血药浓度[12]。基于该研究样本量较小,需要进一步加大样本量来纠正误差,而且该研究并未分析其他抗生素选择和调整,在一定程度上可能影响结果的可靠性。
重症G+球菌感染病人中经验性与非经验性使用万古霉素的疗效和预后分析
Efficacy and prognosis analysis of empirical and non-empirical use of vancomycin in patients with severe G+ cocci infection
-
摘要:
目的比较重症革兰阳性(G+)球菌感染病人经验性与非经验性使用万古霉素在治疗效果、血药浓度和预后之间是否有差异,分析影响病人死亡的临床相关因素。 方法根据有无确切病原学证据将病人治疗分组,无病原学证据,经验使用万古霉素设为E组;有确切病原学培养证据证实G+球菌感染使用万古霉素设为P组。比较2组谷血药浓度、7d抗感染治愈率、28 d生存率、肾功能等预后和疗效。使用logistic多因素回归分析病人死亡的临床相关因素。 结果共纳入60例重症感染病人,其中E组39例,P组21例,2组之间年龄、体质量、生化指标、病情轻重、谷浓度等差异无统计学意义(P>0.05),但使用万古霉素72 h后的体温和28 d生存率差异有统计学意义(P < 0.05)。logistic多因素回归分析相关临床因素发现万古霉素谷浓度尿素氮和培养证实球菌感染与病人死亡相关。 结论和非经验使用万古霉素相比,经验性用药会降低病人28 d生存率,并影响病人抗感染疗效,而2组在血药浓度上并无差异。临床病人的肾功能尿素氮和培养证实球菌感染与病人不良预后及死亡相关,故建议确诊G+球菌感染后再使用万古霉素,并且注意监测病人肾功能情况。 Abstract:ObjectiveTo compare the therapeutic effects, blood drug concentration and prognosis between empirical and non-empirical use of vancomycin in patients with severe Gram-positive(G+) cocci infection, and analyze the clinical related factors of affecting patient death. MethodsAccording to the exact etiological evidence, the patients without etiological evidence were treated with vancomycin, and set as the group E; the patients with etiological evidence were treated with vancomycin, and set as the group P.The valley concentration, cure rate of 7 d anti-infection, 28 d survival rate, renal function and curative effects were compared between two groups.The clinical related factors of death in two groups were analyzed using multivariate logistic regression. ResultsAmong 60 patients with severe infection, 39 cases in group E and 21 cases in group P were identified.There was no statistical significance in age, body mass, biochemical index, disease severity and valley concentration between two groups(P>0.05), but the differences of body temperature and 28 d survival rate between two groups after 72 h of tretament with vancomycin were statistically significant(P < 0.05).The results of multivariate logistic regression analysis of related clinical factors showed that the cocci infection was associated with patient death confirmed by ancomycin valley concentration, urea nitrogen and culture. ConclusionsCompared with the non-experimental use of vancomycin, the empirical use of vancomycin can decrease the 28 d survival rate, and affect the patient's anti-infection efficacy, while there is not difference in blood drug concentration between two groups.The clinical patient's kidney function, urea nitrogen and culture confirm that the cocci infection is related to the poor prognosis and death of patients, so it is recommended that vancomycin be administered after the diagnosis of G+ cocci infection, and that renal function should be monitored. -
Key words:
- severe infection /
- Gram-positive cocci /
- empirical medication /
- vancomycin /
- valley concentration /
- intensive care unit
-
表 1 一般资料比较
一般资料 E组(n=39) P组(n=21) uc P 年龄/岁 50.64±16.95 51.43±13.38 0.18* >0.05 性别(男) 29 15 0.06# >0.05 体质量/kg 62.0(55.0, 69.0) 70.0(58.5, 73.5) 1.70 >0.05 抗感染前体温/℃ 39.10(39.00, 39.50) 39.00(38.35, 39.40) 1.61 >0.05 抗感染前白细胞/(×109) 12.81(10.57, 20.15) 12.15(10.65, 17.90) 0.26 >0.05 抗感染前肌酐/(μmol/L) 62.00(49.00, 80.00) 73.00(56.00, 91.00) 1.32 >0.05 抗感染前尿素氮/(mmol/L) 6.50(4.49, 9.20) 7.08(4.66, 9.27) 0.35 >0.05 白蛋白/(g/L) 35.39±4.87 35.59±5.24 0.15* >0.05 GCS评分/分 7.00(5.00, 15.00) 10.50(5.25, 15.00) 0.98 >0.05 APACHEⅡ评分/分 20.21±5.65 18.71±7.04 0.90* >0.05 接受手术病人/例 31 17 0.02# >0.05 接受机械通气/例 30 17 0.013# >0.05 机械通气时间/h 143.00(71.00, 245.00) 72.00(35.50, 234.50) 1.26 >0.05 感染部位/例 颅内 18 10 0.01# >0.05 肺部 37 20 0.00# >0.05 腹腔 4 1 0.54# >0.05 血流 6 7 2.59# >0.05 合并使用抗生素/例 碳氢酶烯类 28 11 2.26# >0.05 β-内酰胺类 18 10 0.01# >0.05 喹诺酮 7 4 0.01# >0.05 *示t值;#示χ2值 表 2 2组谷浓度和疗效的比较
分组 n 万古霉素谷浓度/(mcg/mL) 谷浓度区间例/(mcg/mL) 7 d临床感染
治愈/例使用72h后
体温/℃使用72 h后
白细胞/×1090~10 10~20 >20 E组 39 9.70(5.40, 19.80) 20 10 9 27 38.57±0.65 12.38(9.73, 16.86) P组 21 9.30(5.30, 16.00) 11 7 3 16 38.14±0.73* 11.13(8.00, 16.26) uc — 0.4 0.82# 0.33 2.34 0.62 P — >0.05 >0.05 >0.05 0.022 >0.05 *示t值;#示χ2值 表 3 2组预后指标比较
分组 n 停万古霉素
肌酐/(μmol/L)停万古霉素
尿素氮/(mmol/L)28 d生存
例数/例ICU住院
时间/dE组 39 51.00(38.50, 69.00) 6.71(3.86, 9.37) 14 16.00(10.00, 24.00) P组 21 62.00(52.50, 102.25) 5.13(3.99, 10.23) 2 18.00(11.00, 27.00) uc — 0.41 -0.08 4.86# 0.85 P — >0.05 >0.05 < 0.05 >0.05 *示t值;#示χ2值 表 4 临床因素与死亡相关分析
影响因素 OR(95%CI) 校正OR(95%CI) P 万古霉素谷浓度 0.974(0.808~1.176) 0.766(0.111~5.309) >0.05 年龄 1.041(0.936~1.158) 1.874(0.354~9.915) >0.05 万古霉素谷浓度肌酐 0.930(0.848~1.020) 0.045(0.001~2.302) >0.05 万古霉素谷浓度尿素氮 3.960(1.170~13.400) 1.072(1.008~1.139) < 0.05 白蛋白 1, 155(0.869~1.534) 2.041(0.499~8.349) >0.05 是否手术 1.118(0.812~1.541) 1.663(0.388~7.126) >0.05 是否机械通气 0.914(0.672~1.244) 0.696(0.201~2.414) >0.05 培养证实球菌感染 0.941(0.887~0.998) 0.746(0.561~0.992) < 0.05 -
[1] HASSOUN A, LINDEN PK, FRIEDMAN B.Incidence, prevalence, and management of MRSA bacteremia across patient populations-a review of recent developments in MRSA management and treatment[J].Crit Care, 2017, 21(1):211. [2] TIAN L, ZHANG Z, SUN Z.Antimicrobial resistance trends in bloodstream infections at a large teaching hospital in China:a 20-year surveillance study (1998-2017)[J].Antimicrob Resist Infect Control, 2019, 28(8):86. [3] SIGAKIS MJG, JEWELL E, MAILE MD, et al.Culture-negative and culture-positive sepsis:a comparison of characteristics and outcomes[J].Anesth Analg, 2019, 129(5):1300. doi: 10.1213/ANE.0000000000004072 [4] STRANIERI I, KANUNFRE KA, RODRIGUES JC, et al.Assessment and comparison of bacterial load levels determined by quantitative amplifications in blood culture-positive and negative neonatal sepsis[J].Rev Inst Med Trop Sao Paulo, 2018, 60(10):e61. [5] PALING FP, TROEMAN DPR, WOLKEWITZ M, et al.Rationale and design of ASPIRE-ICU:a prospective cohort study on the incidence and predictors of Staphylococcus aureus and Pseudomonas aeruginosa pneumonia in the ICU[J].BMC Infect Dis, 2017, 17(1):643. [6] YILMAZ M, ELALDI N, BALKANII, et al.Mortality predictors of Staphylococcus aureus bacteremia:a prospective multicenter study[J].Ann Clin Microbiol Antimicrob, 2016, 15(9):7. [7] PETERSIEL N, BITTERMAN R, MANAA A, et al.β-lactam antibiotics vs.vancomycin for the early treatment of enterococcal bacteraemia:A retrospective cohort study[J].Int J Antimicrob Agents, 2019, 53(6):761. doi: 10.1016/j.ijantimicag.2019.03.023 [8] AARTS MA, BRUN-BUISSON C, COOK DJ, et al.Antibiotic management of suspected nosocomial ICU-acquired infection:does prolonged empiric therapy improve outcome[J].Intensive Care Med, 2007, 33(8):1369. doi: 10.1007/s00134-007-0723-y [9] ZASOWSKI EJ, MURRAY KP, TRINH TD, et al.Identification of vancomycin exposure-toxicity thresholds in hospitalized patients receiving intravenous vancomycin[J].Antimicrob Agents Chemother, 2018, 62(1):e01684. [10] FENG DY, ZHOU YQ, ZOU XL, et al.Factors influencing mortality in hospital-acquired pneumonia caused by Gram-negative bacteria in China[J].J Infect Public Health, 2019, 12(5):630. [11] ALVAREZ R, LOPEZ CORTES LE, MOLINA J, et al.Optimizing the clinical use of vancomycin[J].Antimicrob Agents Chemother, 2016, 60(5):2601. doi: 10.1128/AAC.03147-14 [12] LIÑANA GRANELL C, BELLES MEDALL MD, FERRANDO PIQUERES R, et al.Vancomycin dose optimisation comparing a pharmacokinetic/pharmacodynamic model versus the pharmacokinetic model[J].Eur J Hosp Pharm, 2019, 26(1):16. doi: 10.1136/ejhpharm-2017-001222 -




 下载:
下载: