-
肺癌可分为非小细胞肺癌(non-small cell lung cancer,NSCLC)和小细胞肺癌,其中NSCLC占80%~85%[1]。近年程序性死亡因子受体-1(programmed cell death-1,PD-1)的发现为部分NSCLC病人的治疗带来了曙光。PD-1有2个配体,其中PD-L1作为其主要配体之一,是B7蛋白家族成员之一[2]。研究[3]表明,大多数癌症病人使用PD-1/PD-L1抑制剂治疗均会获益,且表达程度越高,可能获益越大。PD-L1高表达NSCLC病人可单独使用免疫检查点抑制剂治疗,低表达或不表达病人则可能需要联合化疗。但PD-L1的检测技术要求较高,大部分医院仍不能开展,且部分病人拒绝或无法进行组织标本的取材;此外,检测费用昂贵,部分病人没有能力检测等原因,均给PD-L1检测带来了困难。因此,探讨PD-L1表达水平与病人的临床特点及影像学特点相关性显得尤为重要[4-5]。本研究回顾性分析行PD-L1检测的NSCLC病人CT表现及临床特征,探讨NSCLC病人PD-L1表达与临床及胸部影像学特征的关系,以期为NSCLC病人的临床免疫治疗提供一定参考。现作报道。
-
利用安徽省立医院病历系统,收集2019年9月1日至2020年3月31日就诊于安徽省立医院NSCLC病人共187例。纳入标准:有完整的病理标本且确诊为NSCLC;预计生存期>3个月;在我院病理科行PD-L1检测,且行PD-L1检测前1个月内进行过胸部CT扫描。排除标准:病理为小细胞肺癌;影像学资料缺失;全身病变明显或合并其他肿瘤。根据病人PD-L1表达的情况,将病人分为高表达组40例、低表达组65例和阴性组82例,其中高表达组和低表达组作为阳性组。
-
187例病人中,74病人标本来源于外科手术,44例来源于气管镜活检,58例来源于肺穿刺标本,另有8例来源于淋巴结穿刺,3例来源于胸水包埋沉渣标本,还有1例为外院白片。PD-L1检测方法采用免疫组织化学(immunohistochemistry, IHC)22C3 pharmDx法。
-
采用Dako Autostainer Link 48全自动免疫组织化学染色系统。主要试剂:一抗为单克隆小鼠抗PD-L1克隆22C3,小鼠linker,显色试剂为改良的碘氧化法活化辣根过氧化物酶(HRP)、二氨基联苯胺(DAB)+底物缓冲液、DAB+显色剂、DAB增强剂。
-
所有组织标本用10%中性甲醛固定,固定时间为6~24 h,将固定后的标本用石蜡包埋,最后再将组织或细胞块连续切片为3 μm厚度的标本。进行染色,包括脱蜡、水化、抗原修复过程。将切片好的标本于60 ℃烤片1 h,使用无水乙醇及二甲苯脱蜡,随后用预热的低pH抗原修复液在97 ℃下孵育30 min,将含有切片的切片架置于Autostainer Link 48仪器,选择IHC 22C3 pharmDx方案,进行自动染色。采用EnVision FLEX两步免疫组织化学染色技术进行染色。首先Bloking室温(25 ℃)孵育5 min,一抗继续在25 ℃下孵育0.5 h,随后使用EnVision FLEX联合小鼠linker在25 ℃下孵育0.5 h,再使用EnVision FLEX/HRP相同温度下孵育0.5 h。采用DAB显色室温下孵育10 min,并使用DAB增强剂室温下再次孵育5 min进行显色增强,最后使用EnVision FLEX苏木素复染。染色完成的切片经乙醇、二甲苯脱水透明后,使用中性树胶封固。制好的切片置于20~25 ℃避光储存。
-
使用IHC 22C3 pharmDx法对肿瘤组织进行染色,染色强度评分标准参照Dako公司提供的标准检测试剂盒的判读标准进行判读,可分为4个等级:0,阴性;1+,弱强度;2+,中等强度;3+,高强度。≥1+均计入染色结果。
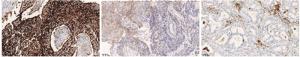
标本的PD-L1表达水平采用肿瘤比例评分(tumor proportion score, TPS)法判定,由2位及以上病理医生,在对病人任何既往临床资料和病理结果均不知情的情况下对检测结果进行评估。使用TPS评价PD-L1的表达程度,即染色阳性的肿瘤细胞数占总活肿瘤细胞数的比例。进行评估时应引起重视的是:TPS染色阳性细胞应只包括可见的肿瘤细胞部分或完整的细胞膜染色,不包括染色的细胞质及免疫细胞。因此,需要有经验的病理科医生进行评估。选取1%及50%两个截断值对TPS染色程度进行分类。(1)TPS<1%:PD-L1表达阴性,即表达PD-L1呈现局部或全部细胞膜染色(≥1+)的肿瘤细胞数占所有肿瘤细胞数的比例<1%;(2)TPS 1%~<50%:PD-L1低表达,即呈现局部或全部细胞膜染色(≥1+)的肿瘤细胞数占所有肿瘤细胞数的比例1%~<50%;(3)TPS≥50%:PD-L1高表达,即呈现局部或全部细胞膜染色(≥1+)的肿瘤细胞数占所有肿瘤细胞数的比例≥50%(见图 1)。
-
采用GE Discovery CT750、light speed VCT、optima CT660、NeuViz 128及philips Brilliance 64进行CT检查,扫描范围包括病人胸廓入口至双侧肾上腺水平整个胸腔。扫描条件:管电压120 kV,管电流自动配置,扫描层厚为5 mm每层。肺窗窗位为1 500 Hu,窗宽-500 Hu;纵膈窗窗位300 HU,窗宽35 Hu。
影像学评估由至少2名具有执业资格的影像学医师进行审核,当意见不一致时由高年资医师再次进行读片复核。肺癌典型影像学特点较多,经查阅资料[6]及反复筛选,最终选取了以下11个胸部CT形态特征进行定性评价,包括分叶、磨玻璃影、解剖学分型、胸膜牵拉征、胸膜增厚、气管支气管侵犯、毛刺、胸腔积液、多发结节、是否存在纤维化、贴近胸膜。
-
采用χ2检验和t检验。
-
187例NSCLC病人中PD-L1阳性105例,阳性表达率56.1%。3组病人性别、年龄、吸烟史和病理类型差异均无统计学意义(P>0.05),3组TNM分期差异有统计学意义(P<0.01)(见表 1)。
变量 n 高表达组 低表达组 阴性组 χ2 P 性别 男 115 25(13.4) 36(19.3) 54(28.9) 1.70 >0.05 女 72 15(8.0) 29(15.5) 28(15.0) 年龄/岁 60 123 64 22(11.8) 40(21.4) 61(32.7) 2.05 >0.05 <60 64 18(9.6) 25(13.4) 21(11.2) 吸烟 是 57 13(7.0) 16(7.5) 28(15.0) 1.65 >0.05 否 130 27(14.4) 49(26.2) 54(28.9) 病理类型 腺癌 147 30(16.0) 51(27.2) 66(35.3) 0.48 >0.05 鳞癌 40 10(5.3) 14(7.5) 16(8.6) TNM分期/期 Ⅰ 65 7(3.7) 32(17.1) 26(14.0) 19.24 <0.01 Ⅱ 19 7(3.7) 6(3.2) 6(3.2) Ⅲ 25 10(5.3) 7(3.7) 8(4.3) Ⅳ 78 16(7.5) 20(10.6) 42(22.4) 表 1 临床资料在3组病人间比较[n;百分率(%)]
-
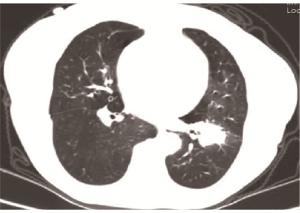
高表达组和低表达组病人胸部CT表现中磨玻璃影、解剖学分型、胸膜牵拉征、胸膜增厚、多发结节、存在纤维化、贴近胸膜比例差异均无统计学意义(P>0.05);而高表达组分叶、气管支气管侵犯、毛刺征、胸腔积液表现比例均较低表达组中多(P<0.05~P<0.01)(见表 2)。高表达组病人典型影像学表现见图 2。
CT表现 n 高表达组 低表达组 χ2 P 分叶 有 47 24 23 6.07 <0.05 无 58 16 42 磨玻璃影 有 21 5 16 2.27 >0.05 无 84 35 49 解剖学分型 中央型 27 14 13 5.38 >0.05 周围型 78 26 52 胸膜牵拉征 有 25 12 13 1.37 >0.05 无 80 28 52 胸膜增厚 有 26 11 15 0.26 >0.05 无 79 29 50 气管支气管侵犯 有 33 20 13 10.34 <0.01 无 72 20 52 毛刺征 有 39 20 19 4.58 <0.05 无 66 20 46 胸腔积液 有 14 10 4 7.61 <0.01 无 91 30 61 多发结节 有 49 21 28 0.88 >0.05 无 56 19 37 纤维化 有 13 6 7 0.41 >0.05 无 92 34 58 贴近胸膜 是 21 10 11 1.01 >0.05 否 84 30 54 表 2 胸部CT特征在高表达和低表达组病人间比较(n)
-
阳性组和阴性组病人胸部CT表现中,肿瘤是否存在分叶、磨玻璃影、解剖学分型、气管支气管侵犯、胸腔积液差异均无统计学差异(P>0.05);而阳性组多见单发结节、有毛刺征,阴性组则多存在肺纤维化、病灶贴近胸膜、胸膜牵拉征、胸膜增厚影像学表现,2组差异均有统计学意义(P<0.05~P<0.01)(见表 3)。
CT表现 n 阳性组 阴性组 χ2 P 分叶 有 73 47 26 3.30 >0.05 无 114 58 56 磨玻璃影 有 29 21 8 3.69 >0.05 无 158 84 74 解剖学分型 中央 92 78 14 2.01 >0.05 周围 92 95 78 27 14 68 胸膜牵拉征 有 63 25 38 10.46 <0.01 无 124 80 44 胸膜增厚 有 70 26 44 16.42 <0.01 无 117 79 38 气管支气管侵犯 有 55 33 22 0.47 >0.05 无 132 72 60 毛刺征 有 51 39 12 11.76 <0.01 无 136 66 70 胸腔积液 有 28 14 14 0.51 >0.05 无 159 91 68 多发结节 有 103 49 54 6.85 <0.01 无 84 56 28 纤维化 有 35 13 22 6.32 <0.05 无 152 92 60 贴近胸膜 有 59 21 38 14.79 <0.01 无 128 84 44 表 3 胸部CT特征在阳性组和阴性组病人间比较(n)
-
PD-1属于免疫球蛋白超家族中一员,相关实验表明,PD-1可能参与了经典类型的程序性死亡[7]。PD-L1作为PD-1的主要配体之一,介导体内PD-1/PD-L1信号通路,肿瘤细胞可通过该途径产生获得性免疫逃逸。现有的免疫治疗,大部分都是通过阻断PD-1/PD-L1信号通路产生免疫反应,从而达到抗肿瘤的目的。
肺癌病人PD-L1高表达意味着对淋巴细胞产生负性调节作用,抑制机体免疫系统对肿瘤细胞的杀伤效应,进而促进了肿瘤进展。肺癌中PD-L1的表达与病人预后相关,PD-L1高表达病人往往预后不佳。近年来,PD-1/PD-L1抑制剂的出现给部分NSCLC病人带来了新的希望。有研究[3]表明,不论肺癌病人PD-L1表达如何,使用PD-L1抑制剂治疗均会获益,而表达程度越高,可能获益越大。PD-L1高表达的NSCLC病人可单独使用免疫检查点抑制剂治疗,低表达或不表达病人则可能需要联合化疗。
既往研究中,PD-L1表达阳性率在0%~82%不等,且不同研究[8-9]中的PD-L1阳性率差异较大,说明影响PD-L1表达的因素较多,且可能与多种因素的相互作用及细胞的共表达有关。本研究中,PD-L1检测阳性率为56.1%,在这一范围内。关于PD-L1与临床病理各因素之间的关系,KONISHI等[10]通过对52例经手术切除的NSCLC标本中PD-L1和PD-L2的表达进行了免疫组织化学检测,结果显示PD-L1表达与临床病理变量和病人的术后生存均没有明显关系;AZUMA等[11]评估了164例经手术切除的NSCLC标本,发现在女性、从不吸烟者和腺癌病人中,PD-L1的表达明显更高。国内有学者也对此进行了相关研究,陈丽娥等[12]以112例NSCLC病人作为研究对象,结果发现不吸烟、鳞癌病人PD-L1阳性率更高,但与年龄、性别、TNM分期无关。本研究根据PD-L1的表达水平对NSCLC病人进行分类,发现不同PD-L1表达与病人的性别、年龄、吸烟史、病理类型差异均无统计学意义,但TNM分期存在明显差异,这可能体现了PD-L1的表达与疾病的进展相关。这些不一致的结果表明,PD-L1的表达可能因种族或居住情况而不同,并且可能有必要分析各亚组之间的临床特征。
由于肿瘤细胞的异质性,各部位PD-L1表达均有可能不同,且随着病情的发展及治疗方式的不同存在动态变化[13]。但是反复多次有创活检对于大部分病人都是不可接受且不现实的,且难以全面评估病人病情状态。而且PD-L1表达检测技术复杂、设备和检测人员要求高、价格昂贵,只有少数省级医院才能开展,县市及医院普遍尚未开展,加之价格昂贵,大部分NSCLC病人不能进行此项检测。因此,迫切需要一种非侵入性、全面、易反复实施的模式,如CT技术。有研究[14]表明,影像学指标联合临床特征、流行病学、临床症状所建立的诊断模型可作为肺癌临床辅助诊断的一种优选方法。影像学特征在肺癌的诊断方面也有重要作用。有学者[15]在一项回顾性的研究中分析了394例肺腺癌病人PD-L1的表达与CT影像学之间的关系,其结果表明PD-L1表达不同,其影像学表现也有不同。王宇等[16]通过对肺腺癌病人行高分辨CT检查发现,PD-L1阳性病人肿瘤较大、密度较高、界限清晰,且胸膜牵拉征、分叶及毛刺征发生率高。如果在NSCLC中建立了CT成像与PD-L1表达的关系,这可能有助于对PD-L1的表达进行动态评估。但关于此类研究的文章却很有限,也难成定论。
本研究通过查阅相关文献、评估肺癌中各个影像学特征的意义,分析了20余个肺癌相关影像学特征,最终筛选出以下11个研究指标:即肿瘤是否存在分叶、磨玻璃影、解剖学分型、胸膜牵拉征、胸膜增厚、气管支气管侵犯、毛刺、胸腔积液、肺癌多发结节、纤维化、病灶贴近胸膜。这些指标均具有一定的临床意义,如胸膜牵拉征是内脏胸膜侵犯的常见症状[17],且与肿瘤的浸润程度有关,肺纤维化通常被视为长期吸烟后果。本研究回顾性分析187例病人PD-L1表达水平与影像学特征之间的关系,发现PD-L1高表达组较低表达组CT表现更容易出现分叶、支气管侵犯、胸腔积液、毛刺征;而PD-L1阳性组和阴性组对比,阳性组多为单发结节、有毛刺征,阴性组则多出现肺纤维化、病灶贴近胸膜、胸膜牵拉征、胸膜增厚。这与国内学者的研究稍有分歧,可能与纳入病人的病理类型不同有关。本研究中纳入了一定比例的鳞癌病人,其对解剖学分型、气管支气管侵犯及病灶是否贴近胸膜均会产生一定影响。
综上,本研究通过分析PD-L1表达差异与病人肺部影像学表现的关联,以期通过临床特征对病人PD-L1的表达做出预测,为一些缺乏检测PD-L1的NSCLC病人的治疗选择提供参考。但本研究为单中心研究,且样本量较小,其结果需要得到更多的验证,其机制需要进一步探索。
非小细胞肺癌病人PD-L1表达与临床及影像学特征关系
Relationship between PD-L1 expression and clinical and imaging features in patients with non-small cell lung cancer
-
摘要:
目的探讨非小细胞肺癌(non small-cell lung cancer,NSCLC)组织中程序性死亡配体-1(programmed cell death ligand-1,PD-L1)的表达与病人临床特征及影像学特征的关系。 方法回顾性分析进行PD-L1检测的NSCLC病人187例的临床特征及胸部影像学特征。根据病人PD-L1表达情况,将病人分为高表达组40例、低表达组65例和阴性组82例,其中高表达组和低表达组作为阳性组。比较各组病人PD-L1表达与临床特征及影像学特征的关系。 结果3组病人性别、年龄、吸烟史及病理类型差异均无统计学意义(P>0.05),TNM分期差异有统计学意义(P < 0.01)。高表达组病人胸部CT表现中分叶、气管支气管侵犯、毛刺征、胸腔积液比例均较低表达组中多见(P < 0.05~P < 0.01)。阳性组肺纤维化、病灶贴近胸膜、胸膜牵拉征、胸膜增厚、多发结节、毛刺征比例差异均有统计学意义(P < 0.05~P < 0.01)。 结论不同PD-L1表达的NSCLC病人TNM分期和影像学特征中胸膜牵拉征、胸膜增厚、毛刺征、多发结节、纤维化、贴近胸膜表现均存在差异。 Abstract:ObjectiveTo explore the relationship between the programmed cell death ligand-1(PD-L1) expression in the tissues of non-small cell lung cancer(NSCLC) and clinical and chest imaging features. MethodsThe clinical features and chest imaging features of 187 NSCLC patients who received PD-L1 detection were retrospectively analyzed.According to the expression of PD-L1, the patients were divided into the high expression group(40 cases), low expression group(65 cases) and negative group (82 cases), and the high expression group and low expression group were regarded as the positive group.The relationship between PD-L1 expression and clinical and imaging features were analyzed and compared among three groups. ResultsThere was no statistical significance in gender, age, smoking history and pathological type among three groups(P>0.05), but there was statistical significance in TNM staging(P < 0.01).The chest CT findings showed that the who patients with lobulation, tracheobronchial invasion, burr sign and pleural effusion in high expression group were more than those in low expression group(P < 0.05 to P < 0.01).The differences of the pulmonary fibrosis, lesions close to the pleura, pleural pull sign, pleural thickening, multiple nodules and burr sign in the positive group were statistically significant(P < 0.05 to P < 0.01). ConclusionsThe TNM staging and imaging features of NSCLC patients with different PD-L1 expressions show the differences in pleural traction sign, pleural thickening, burr sign, multiple nodules, fibrosis, and pleural proximal manifestations. -
表 1 临床资料在3组病人间比较[n;百分率(%)]
变量 n 高表达组 低表达组 阴性组 χ2 P 性别 男 115 25(13.4) 36(19.3) 54(28.9) 1.70 >0.05 女 72 15(8.0) 29(15.5) 28(15.0) 年龄/岁 60 123 64 22(11.8) 40(21.4) 61(32.7) 2.05 >0.05 <60 64 18(9.6) 25(13.4) 21(11.2) 吸烟 是 57 13(7.0) 16(7.5) 28(15.0) 1.65 >0.05 否 130 27(14.4) 49(26.2) 54(28.9) 病理类型 腺癌 147 30(16.0) 51(27.2) 66(35.3) 0.48 >0.05 鳞癌 40 10(5.3) 14(7.5) 16(8.6) TNM分期/期 Ⅰ 65 7(3.7) 32(17.1) 26(14.0) 19.24 <0.01 Ⅱ 19 7(3.7) 6(3.2) 6(3.2) Ⅲ 25 10(5.3) 7(3.7) 8(4.3) Ⅳ 78 16(7.5) 20(10.6) 42(22.4) 表 2 胸部CT特征在高表达和低表达组病人间比较(n)
CT表现 n 高表达组 低表达组 χ2 P 分叶 有 47 24 23 6.07 <0.05 无 58 16 42 磨玻璃影 有 21 5 16 2.27 >0.05 无 84 35 49 解剖学分型 中央型 27 14 13 5.38 >0.05 周围型 78 26 52 胸膜牵拉征 有 25 12 13 1.37 >0.05 无 80 28 52 胸膜增厚 有 26 11 15 0.26 >0.05 无 79 29 50 气管支气管侵犯 有 33 20 13 10.34 <0.01 无 72 20 52 毛刺征 有 39 20 19 4.58 <0.05 无 66 20 46 胸腔积液 有 14 10 4 7.61 <0.01 无 91 30 61 多发结节 有 49 21 28 0.88 >0.05 无 56 19 37 纤维化 有 13 6 7 0.41 >0.05 无 92 34 58 贴近胸膜 是 21 10 11 1.01 >0.05 否 84 30 54 表 3 胸部CT特征在阳性组和阴性组病人间比较(n)
CT表现 n 阳性组 阴性组 χ2 P 分叶 有 73 47 26 3.30 >0.05 无 114 58 56 磨玻璃影 有 29 21 8 3.69 >0.05 无 158 84 74 解剖学分型 中央 92 78 14 2.01 >0.05 周围 92 95 78 27 14 68 胸膜牵拉征 有 63 25 38 10.46 <0.01 无 124 80 44 胸膜增厚 有 70 26 44 16.42 <0.01 无 117 79 38 气管支气管侵犯 有 55 33 22 0.47 >0.05 无 132 72 60 毛刺征 有 51 39 12 11.76 <0.01 无 136 66 70 胸腔积液 有 28 14 14 0.51 >0.05 无 159 91 68 多发结节 有 103 49 54 6.85 <0.01 无 84 56 28 纤维化 有 35 13 22 6.32 <0.05 无 152 92 60 贴近胸膜 有 59 21 38 14.79 <0.01 无 128 84 44 -
[1] XING PY, ZHU YX, WANG L, et al. What are the clinical symptoms and physical signs for non-small cell lung cancer before diagnosis is made? A nation-wide multicenter 10-year retrospective study in China[J]. Cancer Med, 2019, 8(8): 4055. doi: 10.1002/cam4.2256 [2] LIANG SC, LATCHMAN YE, BUHLMANN JE, et al. Regulation of PD-1, PD-L1, and PD-L2 expression during normal and autoimmune responses[M]. Moecular genetic approaches to protein structure and function: Alan R. Liss, 2003. [3] VOKES EE, READY N, FELIP E, et al. Nivolumab versus docetaxel in previously treated advanced non-small cell lung cacer(CheckMate 017 and CheckMate 057): 3-year update and outcomes in patients with Liver metastases[J]. Ann Oncol, 2018, 29(4): 959. doi: 10.1093/annonc/mdy041 [4] 付亮, 王宏亮, 赵钰. 周围型肺癌在多层螺旋CT诊断中的影像学表现与术后病理学诊断的一致性分析[J]. 中国CT和MRI杂志, 2020, 18(4): 43. doi: 10.3969/j.issn.1672-5131.2020.04.014 [5] BÜTTNER R, GOSNEY JR, GULDHAMMER BG, et al. Programmed death-ligand 1 immunohistochemistry testing: a review of analytical assays and clinical implementation in non-small-cell lung cancer[J]. J Clin Oncol, 2017, 35(34): 3867. doi: 10.1200/JCO.2017.74.7642 [6] KARLO CA, DI PAOLO PL, CHAIM J, et al. Radiogenomics of clear cell renal cell carcinoma: associations between ct imaging features and mutations[J]. Radiology, 2013, 270(2): 464. [7] ISHIDA Y, AGATA Y, SHIBAHARA K, et al. Induced expression of PD-1, a novel member of the immunoglobulin gene superfamily, upon programmed cell death[J]. EMBO J, 1992, 11(11): 3887. doi: 10.1002/j.1460-2075.1992.tb05481.x [8] TANG YW, FANG Y, ZHANG, et al. The association between PD-L1 and EGFR status and the prognostic value of PD-L1 in advanced non-small cell lung cancer patients treated with EGFR-TKIs[J]. Oncotarget, 2015, 6(16): 14209. doi: 10.18632/oncotarget.3694 [9] PARRA ER, VILLALOBOS P, JIEXIN Z. Immunohistochemical and Iimage analysis-based study shows that several immune checkpoints are co-expressed in non-small cell lung carcinoma tumors[J]. J Thorac Oncol, 2018, 13(6): 779. doi: 10.1016/j.jtho.2018.03.002 [10] KONISHI J, YAMAZAKI K, AZUMA M, et al. B7-H1 expression on nonsmall cell lung cancer cells and its relationship with tumor——infiltrating lymphocytes and their PD-1 expression[J]. Clin Cancer Res, 2004, 10(15): 5094. doi: 10.1158/1078-0432.CCR-04-0428 [11] AZUMA K, OTA K, KAWAHARA A, et al. Association of PD-L1 overexpression with activating EGFR mutations in surgically resected nonsmall-cell lung cancer[J]. Ann Oncol, 2014, 25(10): 1935. doi: 10.1093/annonc/mdu242 [12] 陈丽娥, 王识华, 洪湘, 等. 非小细胞肺癌患者PD-L1表达水平与临床病理特征及细胞免疫的关系[J]. 中国医师杂志, 2020, 22(8): 1266. doi: 10.3760/cma.j.cn431274-20200227-00201 [13] 潘莹莹, 周斐, 周彩存. 肺癌免疫治疗的前景与挑战[J]. 中国癌症杂志, 2019, 29(4): 241. [14] 倪然. 基于流行病学、临床症状、肿瘤标志和影像学特征的肺癌诊断模型的建立[D]. 郑州: 郑州大学, 2016. [15] PARDOLL DM. The blockade of immune checkpoints in cancer immunotherapy[J]. Nat Rev Cancer, 2012, 12(4): 252. doi: 10.1038/nrc3239 [16] 王宇. 肺腺癌的HRCT影像表现与病理分型、PD-L1表达相关性研究[J]. 石家庄: 河北医科大学, 2020. [17] SHINYA N, TOSHI M, TERUMASA S, et al. Prognostic impact of microscopic vessel invasion and visceral pleural invasion and their correlations with epithelial-mesenchymal transition, cancer stemness, and treatment failure in lung adenocarcinoma[J]. Lung Cancer, 2019, 128: 13. doi: 10.1016/j.lungcan.2018.12.001 -




 下载:
下载: