-
卵巢癌是全球第二致命的妇科恶性肿瘤,也是导致女性癌症相关死亡的第七大常见原因[1]。由于其发病隐匿,且缺乏有效可靠的诊断方法,大多数卵巢癌病人发展到晚期时才被发现,并且在原发性细胞减灭术和标准的一线化疗后再次发现病灶[2]。尽管治疗手段在不断的改进和更新,但卵巢癌病人的生存率仍没有明显的提高[3],所以需要探索更加有效的新的治疗方法。中医中药在医疗保健系统中发挥重要作用,从中药中筛选开发抗肿瘤新药是非常好的策略。二氢杨梅素存在于多种藤茶植物中,属于黄酮类化合物,文献[4]报道其具有很好的调节血糖和血脂、调理免疫功能、抗氧化、保护肝脏、抗凋亡、抗癌等多方面的药理活性[4]。而二氢杨梅素这些药理作用的机制分别与调节包括葡萄糖代谢和TCA循环在内的24种代谢途径[5]、激活PI3K/Akt/FoxO3a信号通路[6]、调节脂质平衡以及肝细胞的死亡和再生[7]、MAPKs和PI3K/AKT介导的信号通路以及线粒体功能障碍[8]、TFEB通路介导的自噬[9]等有关。另外还发现,二氢杨梅素可通过影响MAPK/ERK通路而下调MAR1 mRNA和P-gp的表达,从而增强阿奇霉素的抗肿瘤作用[10]。这些实验结果均为本研究奠定了基础。本文则主要从对细胞生长、凋亡及信号转导通路方面的影响探究二氢杨梅素对人卵巢癌HO-8910细胞的作用,为进一步开发二氢杨梅素提供依据。
-
二氢杨梅素(购于国家标准物质网,批号MUST-13015108),HPLC测得其质量分数>99%;MTT(Amresco Inc公司);CCK-8溶液(日本同仁化学研究所);RPMI-1640培养基(美国Sigma公司);膜联蛋白Ⅴ(Annexin Ⅴ)-异硫氰酸荧光素(fluoresceineisothiocyanate, FITC)/碘化丙啶(propidium iodide, PI)双染细胞凋亡检测试剂盒(南京凯基生物技术有限公司);Hoechst 33258染液(上海碧云天公司);ERK、p-ERK、GAPDH、Bax、Bcl-2、caspase-3兔抗人单克隆抗体(美国CST公司);371型CO2培养箱(Thermo Fisher公司);MK3型酶标仪(美国THERMO公司);IX73倒置显微镜(Olympus公司);BSA124S电子天平(美国Sartorius公司);FACSCanto Ⅱ型流式细胞仪(美国BD公司)。
-
常规复苏人卵巢癌细胞株HO-8910(购自北京鼎国昌盛公司),加入补充了10%FBS以及100 U/mL青霉素、100 μg/mL链霉素的RPMI-1640培养液中,按细胞提供者规定的条件将细胞于37 ℃、含有5%CO2恒温潮湿环境中培养。当细胞繁殖至整个培养皿表面的80%时,用2.5 g/L的胰酶进行消化和传代,并用于实验。
-
取对数期生长优良的HO-8910细胞,常规处理后用RPMI1640培养液调整成5×104个/毫升密度的细胞悬浮液,每孔100 μL加入96孔板,待细胞生长融合至60%后随机分组,给药组分别加入不同浓度二氢杨梅素溶液(终浓度分别为10、20、40 μmol/L),细胞对照组加入等量培养液,每个组平行6个复孔,培养24 h,移弃上清液,PBS清洗各孔后加入5 mg/mL的MTT溶液20 μL,培养4 h再次更换上清液为DMSO溶液100 μL,摇床上震荡使紫色结晶溶解均匀,将酶标仪设置波长为490 nm,以空白对照孔调零,检测各孔吸光度(OD)值,OD值越高代表细胞数量越多。并计算细胞增殖抑制率(%)=[(空白组OD-药物组OD)/空白组OD]×100%。
-
将培养至对数生长期的HO-8910细胞,加入RPMI1640培养液调整成5×104个/毫升的单细胞悬液加入96孔板,每孔100 μL,恒温恒湿培养24 h后将所有孔随机分为7组,药物组分别加入不同浓度二氢杨梅素(终浓度分别为10、20、40 μmol/L),空白对照组加入等量培养基,每组平行6个复孔。常规培养48 h后各孔加入CCK-8工作液10 μL混匀,继续培养2 h后,结合试剂盒说明书记录酶标仪450 nm波长处的OD值,同上公式计算细胞增殖抑制率。
-
同上述方法将对数生长期的HO-8910细胞制成密度为1×106个/毫升的细胞悬液,充分吹打使分散均匀后接种于6孔板中,37 ℃、5%CO2培养箱中培养24 h后随机分组,用10、20、40 μmol/L的二氢杨梅素处理细胞另设不加药的空白对照,每组3个平行孔,48 h后取出用胰酶消化,PBS清洗后加入300 μL的Binding缓冲液悬浮细胞,加入Annexin V-FITC 5 μL、PI染色液5 μL轻柔混匀避光反应,最后通过流式细胞仪检测细胞凋亡情况,记录实验结果。
-
按照1.2.4方法将接种、培养、分组并用相应药物作用HO-8910细胞,培养48 h,吸出上清旧培养液后用PBS进行清洗,各孔均加入4%多聚甲醛室温固定20 min,PBS洗涤2次,并用10%BSA溶液封闭10 min,再次用PBS洗涤后,每孔用0.5 mL Hoechst 33258室温避光染色15 min,吸净表面染色液,用PBS轻轻漂洗2次后封片,于荧光显微镜下进行对比观察,正常细胞染色质分布均匀,核被染成的蓝色呈均匀状态;核呈浓缩、碎裂的明亮蓝色细胞则是凋亡细胞,随机选取视野拍片,保持曝光度和对比度一致。
-
按照1.2.4方法将接种、培养、分组并分别加入相应药物作用HO-8910细胞,培养48 h,去除培养液并收集细胞,加入含蛋白酶抑制剂的RIRA裂解液100 μL吹打均匀,置冰上裂解细胞30 min,4 ℃ 14 000 r/min离心10 min提取上清总蛋白,每管取15 μg总蛋白加入上样缓冲液煮沸5 min,行10%SDS-PAGE(55 V 30 min,95 V 90 min)凝胶电泳分离蛋白,后25 V恒压下转至PVDF膜25 min;37 ℃ 5%脱脂牛奶中封闭1 h。加入一抗(Caspase-3、Bcl-2、Bax、ERK、p-ERK、β-actin,稀释度均为1∶ 1 000)溶液4 ℃过夜,洗膜。加入辣根过氧化物酶标记的二抗溶液,37 ℃振摇1 h。PBS溶液振摇洗膜3次,采用二氨基联苯胺发光显影液显色,以GAPDH为参比,采用Image Pro Plus 6.0软件分析目标条带的相对灰度值,计算各蛋白条带与内参照的相对表达水平。
-
采用方差分析及q检验。
-
同时采用MTT和CCK-8法检测二氢杨梅素对HO-8910细胞活性的影响,2种方法检测的二氢杨梅素体外对HO-8910细胞活性的抑制作用趋势一致,均随着药物浓度的增加而增高(P<0.01),各组细胞生长抑制率与空白对照组差异有统计学意义(P<0.05),因此可见二氢杨梅素体外可抑制HO-8910细胞的生长,并具有浓度依赖性(见表 1~2)。
分组 n OD值(x±s) 抑制率/% 空白对照 6 0.727±0.075 — 二氢杨梅素10 μmol/L 6 0.629±0.064* 13.81 二氢杨梅素20 μmol/L 6 0.514±0.083*# 29.61 二氢杨梅素40 μmol/L 6 0.435±0.073*# 40.41 F — 17.99 — P — <0.01 — MS组内 — 0.005 — q检验:与空白对照组比较*P<0.05;与二氢杨梅素10 μmol/L组比较#P<0.05;与二氢杨梅素20 μmol/L组比较▲P<0.05 表 1 MTT法检测二氢杨梅素对HO-8910细胞增殖的抑制作用
分组 n OD值(x±s) 抑制率/% 空白对照 6 0.742±0.073 — 二氢杨梅素10 μmol/L 6 0.626±0.066* 15.43 二氢杨梅素20 μmol/L 6 0.526±0.084*# 28.99 二氢杨梅素40 μmol/L 6 0.427±0.072*#▲ 42.34 F — 19.95 — P — <0.01 — MS组内 — 0.006 — q检验:与空白对照组比较*P<0.05;与二氢杨梅素10 μmol/L组比较#P<0.05;与二氢杨梅素20 μmol/L组比较▲P<0.05 表 2 CCK-8法检测二氢杨梅素对HO-8910细胞增殖的抑制作用
-
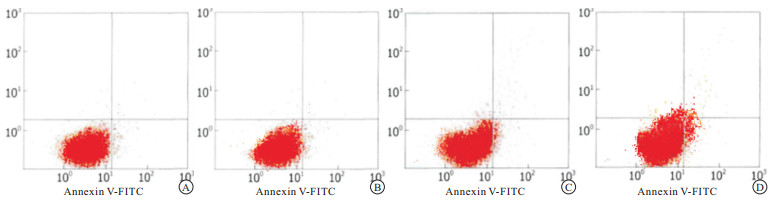
流式细胞仪检测10、20、40 μmol/L二氢杨梅素分别与HO-8910细胞共同作用48 h,结果显示,各药物组凋亡率均明显高于空白对照组(P<0.05)。且细胞凋亡率随着二氢杨梅素浓度的升高而增加,具有浓度依赖性(见图 1、表 3)。
分组 n 凋亡率/% 空白对照 3 4.99±0.52 二氢杨梅素10 μmol/L 3 7.86±0.57* 二氢杨梅素20 μmol/L 3 22.61±2.59*# 二氢杨梅素40 μmol/L 3 33.35±3.24*#▲ F — 130.63 P — <0.01 MS组内 — 2.951 q检验:与空白对照组比较*P<0.05;与二氢杨梅素10 μmol/L组比较#P<0.05;与二氢杨梅素20 μmol/L组比较▲P<0.05 表 3 二氢杨梅素对HO-8910细胞凋亡的影响(x±s)
-
不同浓度的二氢杨梅素与HO-8910细胞共同作用48 h后,荧光显微镜下可观察到细胞出现明显的凋亡特征,细胞体积缩小,细胞质逐渐浓缩,并发出明亮蓝色荧光,这种变化随着药物浓度的增加愈发明显;而空白对照组细胞则排列整齐,大小均一,表现为均匀的蓝色(见图 2)。
-
Western blotting结果显示,与空白对照组相比,二氢杨梅素作用于HO-8910细胞后,随浓度的增加,抑凋亡蛋白Bcl-2表达逐渐降低,促凋亡蛋白Bax和caspase-3表达则逐渐升高,差异具有统计学意义(P<0.05)(见图 3、表 4)。
分组 n Caspase-3 Bax Bcl-2 空白对照 3 0.73±0.21 0.42±0.11 1.33±0.09 二氢杨梅素10 μmol/L 3 1.33±0.11* 0.73±0.15* 0.94±0.15* 二氢杨梅素20 μmol/L 3 1.71±0.08*# 0.91±0.14* 0.84±0.11* 二氢杨梅素40 μmol/L 3 2.20±0.17*#▲ 0.96±0.08* 0.68±0.12* F — 50.52 11.60 16.56 P — <0.01 <0.01 <0.01 MS组内 — 0.023 0.022 0.015 q检验:与空白对照组比较*P<0.05;与10 μmol/L组比较#P<0.05;与20 μmol/L组比较▲P<0.05 表 4 二氢杨梅素对HO-8910细胞凋亡相关蛋白的影响(x±s)
-
Western blotting结果显示,与空白对照组比较,二氢杨梅素作用于HO-8910细胞后,通路蛋白ERK、p-ERK的表达显著下调(P<0.05),提示二氢杨梅素可通过抑制MAPK/ERK通路来诱导HO-8910细胞凋亡(见图 4、表 5)。
分组 n ERK p-ERK 空白对照 3 2.19±0.07 2.55±0.14 二氢杨梅素10 μmol/L 3 1.98±0.08* 2.08±0.23* 二氢杨梅素20 μmol/L 3 1.83±0.14* 1.77±0.21* 二氢杨梅素40 μmol/L 3 1.49±0.16*#▲ 0.82±0.18*#▲ F — 17.78 43.02 P — <0.01 <0.01 MS组内 — 0.016 0.045 q检验:与空白对照组比较*P<0.05;与10 μmol/L组比较#P<0.05;与20 μmol/L组比较▲P<0.05 表 5 二氢杨梅素对HO-8910细胞凋亡通路蛋白的影响(x±s)
-
二氢杨梅素是我国近些年来新开发的一种黄酮醇类黄酮化合物,在自然界植物中含量丰富。作为一种天然存在的产物,二氢杨梅素的药用功效多而广泛,可调节多条通路、影响多种机制, 对多种肿瘤产生拮抗生长的作用。卵巢癌是在女性中常见的、并且较难治愈的生殖系统疾病,且发病年龄逐渐趋向年轻。因肿瘤细胞自身可大量分泌生长因子受体,直接导致细胞无节制地受到增殖信号刺激,无限分裂增殖,而凋亡相对减少,所以对肿瘤细胞生长的抑制能力是评判抗肿瘤药物有效率的首要标准[11]。本研究同时采用MTT和CCK-8两种方法检测二氢杨梅素对人卵巢癌HO-8910细胞体外增殖的影响,结果均表明随着二氢杨梅素浓度的增加,细胞数量逐渐减少,即对HO-8910细胞的抑制作用逐渐增加。流式细胞仪检测发现,二氢杨梅素可明显促进HO-8910细胞凋亡,且凋亡率随浓度增大而增加。Hoechst 33258荧光染色检测结果表明,空白对照组细胞排列整齐,大小均一,二氢杨梅素作用的HO-8910细胞则出现明显的凋亡特征,表现为细胞皱缩,呈强荧光反应,随着药物浓度增加,细胞凋亡率明显上升。以上结果均证明了二氢杨梅素通过诱导HO-8910细胞凋亡而抑制其生长。
细胞凋亡是维持内环境稳定的细胞生理性的自动结束生命的过程,被精密控制,发生于胚胎发育、组织重建、免疫调节及肿瘤退化的各个阶段[12]。只有当凋亡减少,增殖和凋亡水平不再平衡,出现无限增殖的时候才形成肿瘤凋亡,所以凋亡逃逸即表明着癌症的发生。凋亡的发生过程是在多种基因和多条信号通路共同参与下进行,其中Caspase家族在整个过程中起着不可替代的作用[13],尤其是作为细胞凋亡途径中重要的执行因子之一的Caspase-3,是多种凋亡蛋白级联反应的必经之路。Bcl-2蛋白是与凋亡密切相关的Bcl-2家族中最关键的抗凋亡基因,定位于人染色体18q2113,可阻断Caspase-3诱导的细胞凋亡过程[14]。研究[15]发现,Bcl-2与细胞增殖存在着紧密联系,如miR-371-5p基因可通过对Bcl-2的靶向作用而削减人鼻咽癌细胞无限增殖和进行迁移的能力。Bax是与Bcl-2共沉淀的促进细胞凋亡的基因,Bcl-2/Bax比值可影响线粒体释放Cyt-C的能力,进而影响下游Caspase的激活从而平衡调控细胞凋亡。本研究Western blotting结果显示,二氢杨梅素能浓度依赖性地上调凋亡启动因子Caspase-3和促凋亡因子Bax,下调抑凋亡因子Bcl-2,这些结果进一步证实了二氢杨梅素能够诱导人卵巢癌HO-8910细胞的凋亡。
细胞的存活受增殖和凋亡比例的影响。丝裂原活化蛋白激酶/细胞外信号调节激酶(MAPK/ERK)信号转导途径通过调节下游的基因蛋白参与调控细胞的增殖、分裂、死亡等多种过程,在许多癌症中均能促进肿瘤生长。ERK是一类丝/苏氨酸蛋白激酶,是MAPK家族众多成员中最重要的环节,也是该通路中的关键调节成分[16]。它位于细胞质内,只有在信号刺激下磷酸化成p-ERK才能表现出对细胞分化、增殖、存活等多种环节进行调节的活性,并分泌炎症因子,产生各种效应。目前已发现的ERK家族中ERK1和ERK2是研究的较为清楚的[17]。在多种肿瘤中存在ERK的过度激活,其一面接收来自细胞外的激素、生长因子以及环境刺激等信号被激活;一面又影响核转录因子AP-1、核转录因子-κB等的表达[18],从而介导和放大肿瘤的转移过程。我们发现不同浓度的二氢杨梅素与HO-8910细胞共同作用后,通路蛋白ERK、p-ERK的表达明显降低,其降低程度与浓度增长均成负相关,因此推测二氢杨梅素可能通过抑制ERK/ MAPK通路,从而抑制HO-8910细胞的增殖并诱导其凋亡。
综上,本研究发现二氢杨梅素能通过调节ERK/MAPK通路、促进关键蛋白Caspase-3和Bax的表达,下调Bcl-2的表达,有效抑制人卵巢癌HO-8910细胞的生长。而目前已有多项研究寻找有关制剂切断ERK信号途径以达到治疗肿瘤的目的,结合本研究提示ERK/MAPK通路可能是卵巢癌治疗的靶点,为卵巢癌的临床治疗提供了参考。
二氢杨梅素诱导人卵巢癌HO-8910细胞凋亡及机制研究
Study on the apoptosis induced by dihydromyricetin in human ovarian cancer HO-8910 cells and its mechanism
-
摘要:
目的二氢杨梅素体外对人卵巢癌HO-8910细胞生长、凋亡的影响,及其作用机制的探讨。 方法体外培养HO-8910细胞,以不同浓度(10、20、40 μmol/L)的二氢杨梅素作用于HO-8910细胞,MTT法及CCK-8法检测对细胞生长的抑制作用;AnnexinV-FITC/PI双染流式细胞仪检测对细胞凋亡的影响;Hoechst 33258荧光染色观察细胞凋亡情况;Western blotting法检测Caspase-3、Bcl-2、Bax、ERK、p-ERK蛋白表达情况。 结果MTT和CCK-8结果均显示二氢杨梅素可浓度依赖性地抑制HO-8910细胞的生长;流式细胞仪结果显示二氢杨梅素可浓度依赖性促进HO-8910细胞凋亡;Hoechst 33258荧光染色结果显示,二氢杨梅素作用后的HO-8910细胞呈现典型凋亡形态学改变;Western blotting结果显示二氢杨梅素可上调HO-8910细胞Caspase-3和Bax水平,下调Bcl-2、ERK、p-ERK水平(P < 0.05)。 结论二氢杨梅素具有抗人卵巢癌HO-8910细胞活性的作用,并诱导其凋亡,其作用机制与调控ERK/MAPK信号通路有关。 Abstract:ObjectiveTo investigate the effects of dihydromyricetin on the growth and apoptosis of human ovarian cancer HO-8910 cells, and its mechanism. MethodsThe HO-8910 cells were cultured in vitro, and treated with dihydromyricetin at different concentrations(10, 20 and 40 μmol/L).The proliferation of cells was detected using MTT and CCK-8 method, the apoptosis of cells was detected using the Annexin V-FITC/PI flow cytometry and Hoechst 33258 fluorescence staining, and the expression levels of Caspase-3, Bcl-2, Bax, ERK and p-ERK protein were detected using Western blotting. ResultsThe results of MTT and CCK-8 was showed that dihydromyricetin could inhibit the growth of HO-8910 cells in a concentration-dependent manner.The results of flow cytometry showed that dihydromyricetin could promote the HO-8910 cell apoptosis in a concentration-dependent manner.The typical morphological changes of apoptosis in HO-8910 cells treated with dihydromyrmectin were found using Hoechst 33258 fluorescence staining.The results of Western blotting showed that dihydromyricetin could up-regulate the levels of Caspase-3 and Bax, and down-regulate the levels of Bcl-2, ERK and p-ERK in HO-8910 cells(P < 0.05). ConclusionsDihydromyricetin can inhibit the activity of human ovarian cancer HO-8910 cells and induce their apoptosis, and the mechanism of which is related to the regulation of ERK/MAPK signaling pathway. -
Key words:
- ovarian neoplasms /
- dihydromyricetin /
- HO-8910 cells /
- proliferation /
- apoptosis
-
表 1 MTT法检测二氢杨梅素对HO-8910细胞增殖的抑制作用
分组 n OD值(x±s) 抑制率/% 空白对照 6 0.727±0.075 — 二氢杨梅素10 μmol/L 6 0.629±0.064* 13.81 二氢杨梅素20 μmol/L 6 0.514±0.083*# 29.61 二氢杨梅素40 μmol/L 6 0.435±0.073*# 40.41 F — 17.99 — P — <0.01 — MS组内 — 0.005 — q检验:与空白对照组比较*P<0.05;与二氢杨梅素10 μmol/L组比较#P<0.05;与二氢杨梅素20 μmol/L组比较▲P<0.05 表 2 CCK-8法检测二氢杨梅素对HO-8910细胞增殖的抑制作用
分组 n OD值(x±s) 抑制率/% 空白对照 6 0.742±0.073 — 二氢杨梅素10 μmol/L 6 0.626±0.066* 15.43 二氢杨梅素20 μmol/L 6 0.526±0.084*# 28.99 二氢杨梅素40 μmol/L 6 0.427±0.072*#▲ 42.34 F — 19.95 — P — <0.01 — MS组内 — 0.006 — q检验:与空白对照组比较*P<0.05;与二氢杨梅素10 μmol/L组比较#P<0.05;与二氢杨梅素20 μmol/L组比较▲P<0.05 表 3 二氢杨梅素对HO-8910细胞凋亡的影响(x±s)
分组 n 凋亡率/% 空白对照 3 4.99±0.52 二氢杨梅素10 μmol/L 3 7.86±0.57* 二氢杨梅素20 μmol/L 3 22.61±2.59*# 二氢杨梅素40 μmol/L 3 33.35±3.24*#▲ F — 130.63 P — <0.01 MS组内 — 2.951 q检验:与空白对照组比较*P<0.05;与二氢杨梅素10 μmol/L组比较#P<0.05;与二氢杨梅素20 μmol/L组比较▲P<0.05 表 4 二氢杨梅素对HO-8910细胞凋亡相关蛋白的影响(x±s)
分组 n Caspase-3 Bax Bcl-2 空白对照 3 0.73±0.21 0.42±0.11 1.33±0.09 二氢杨梅素10 μmol/L 3 1.33±0.11* 0.73±0.15* 0.94±0.15* 二氢杨梅素20 μmol/L 3 1.71±0.08*# 0.91±0.14* 0.84±0.11* 二氢杨梅素40 μmol/L 3 2.20±0.17*#▲ 0.96±0.08* 0.68±0.12* F — 50.52 11.60 16.56 P — <0.01 <0.01 <0.01 MS组内 — 0.023 0.022 0.015 q检验:与空白对照组比较*P<0.05;与10 μmol/L组比较#P<0.05;与20 μmol/L组比较▲P<0.05 表 5 二氢杨梅素对HO-8910细胞凋亡通路蛋白的影响(x±s)
分组 n ERK p-ERK 空白对照 3 2.19±0.07 2.55±0.14 二氢杨梅素10 μmol/L 3 1.98±0.08* 2.08±0.23* 二氢杨梅素20 μmol/L 3 1.83±0.14* 1.77±0.21* 二氢杨梅素40 μmol/L 3 1.49±0.16*#▲ 0.82±0.18*#▲ F — 17.78 43.02 P — <0.01 <0.01 MS组内 — 0.016 0.045 q检验:与空白对照组比较*P<0.05;与10 μmol/L组比较#P<0.05;与20 μmol/L组比较▲P<0.05 -
[1] VETTER MH, HAYS JL. Use of targeted therapeutics in epithelial ovarian cancer: a review of current literature and future directions[J]. Clin Ther, 2018, 40(3): 361. doi: 10.1016/j.clinthera.2018.01.012 [2] ENDO H, HAMA N, BAGHDADI M, et al. Interleukin-34 expression in ovarian cancer: a possible correlation with disease progression[J]. Int Immunol, 2020, 32(3): 175. doi: 10.1093/intimm/dxz074 [3] NAMEE NM, ODRISCOLL L. Extracellular vesicles and anti-cancer drug resistance[J]. Biochim Biophys Acta, 2018, 12(2): 123. [4] 谢蓉蓉, 孙福强. 天然产物二氢杨梅素的研究进展[J]. 广东药科大学学报, 2019, 35(3): 470. [5] LE L, JIANG B, WAN W, et al. Metabolomics reveals the protective of Dihydromyricetin on glucose homeostasis by enhancing insulin sensitivity[J]. Sci Rep, 2016, 6: 36184. doi: 10.1038/srep36184 [6] ZHANG X, WANG L, PENG L, et al. Dihydromyricetin protects HUVECs of oxidative damage induced by sodium nitroprusside through activating PI3K/Akt/FoxO3a signalling pathway[J]. J Cell Mol Med, 2019, 23(7): 4829. doi: 10.1111/jcmm.14406 [7] DONG S, JI J, HU L, et al. Dihydromyricetin alleviates acetaminophen-induced liver injury via the regulation of transformation, lipid homeostasis, cell death and regeneration[J]. Life Sci, 2019, 227: 20. doi: 10.1016/j.lfs.2019.04.019 [8] FENG QW, CUI ZG, JIN YJ, et al. Protective effect of dihydromyricetin on hyperthermia-induced apoptosis in human myelomonocytic lymphoma cells[J]. Apoptosis, 2019, 24(3/4): 290. [9] TAN M, JIANG B, WANG H, et al. Dihydromyricetin induced lncRNA MALAT1TFEB-dependent autophagic cell death in cutaneous squamous cell carcinoma[J]. J Cancer, 2019, 10(18): 4245. doi: 10.7150/jca.32807 [10] SUN Y, WANG C, MENG Q, et al. Targeting P-glycoprotein and SORCIN: Dihydromyricetin strengthens anti-proliferative efficiency of adriamycin via MAPK/ERK and Ca -mediated apoptosis pathways in MCF-7/ADR and K562/ADR[J]. J Cell Physiol, 2018, 233(4): 3066. doi: 10.1002/jcp.26087 [11] HANAHAN D, WEINBERG RA. Hallmarks of cancer: the next generation[J]. Cell, 2011, 144(5): 646. doi: 10.1016/j.cell.2011.02.013 [12] GIANSANTI V, TORRIGLIA A, SCOVASSI AI. Conversation between apoptosis and autophagy: "Is it your turn or mine?"[J]. Apoptosis, 2011, 16(4): 321. doi: 10.1007/s10495-011-0589-x [13] HASNAT M, YUAN Z, ULLAH A, et al. Mitochondria-dependent apoptosis in triptolide-induced hepatotoxicity is associated with the Drp1 activation[J]. Toxicol Mech Methods, 2020, 30(2): 124. doi: 10.1080/15376516.2019.1669247 [14] KONTOS CK, CHRISTODOULOU MI, SCORILAS A. Apoptosis-related BCL2-family membem: Key players in chemotherapy[J]. Anti Cancer Agents Med Chem, 2014, 14(3): 353. doi: 10.2174/18715206113139990091 [15] DENG B, SU F, XIE R, et al. MiR-371-5p suppresses the proliferative and migratory capacity of human nasopharyngeal carcinoma by targeting BCL2[J]. Oncol Lett, 2018, 15(6): 9209. [16] 张琼, 甘怀勇, 武世伍. WWOX与ERK1在食管鳞状细胞癌中表达及其临床病理意义[J]. 蚌埠医学院学报, 2020, 45(10): 1313. [17] SAMMONS RM, PERRY NA, LI Y, et al. A novel class of common docking domain inhibitors that prevent ERK2 activation and substrate phosphorylation[J]. ACS Chem Biol, 2019, 14(6): 1183. doi: 10.1021/acschembio.9b00093 [18] 荆薇, 张晔, 刘云鹏, 等. ERK通路对胃癌细胞顺铂敏感性的调节作用[J]. 世界华人消化杂志, 2009, 17(28): 2931. -





 下载:
下载: