-
心房颤动(房颤)是临床上最常见的心律失常。心房纤维化导致心脏局部电流传导减慢,增加传导异质性,是房颤发生发展的结构基础[1]。房颤发生时,病人常会出现心悸、气短、运动不耐受、胸痛不适等症状,严重影响病人生活质量,有效预防和治疗房颤仍是一个亟待解决的医学问题[2]。细胞分裂周期蛋白42(Cdc42)为Rho GTP酶家族中研究最多的一个亚型,除了作为细胞骨架重塑的重要调控因子外,Cdc42还参与了基因转录、细胞周期和细胞存活信号通路的调控[3]。研究[4]表明,Rho GTP酶家族在心血管疾病的发病机制中起重要作用,抑制Cdc42可降低高血压病人心肌纤维化和肥厚程度[5]。近年来发现的转录辅助激活因子Yes相关蛋白(YAP)对心肌细胞的增殖作用引起了广泛关注。YAP对促细胞增殖和抑制细胞凋亡的相关基因起到调控作用,YAP过表达可有效刺激心肌细胞增殖,消融YAP则导致心脏发育不良[6-7]。这些研究表明YAP在正常和病理条件下都是心肌细胞生长控制的中心角色。本研究试图分析Cdc42及YAP在房颤病人血清中表达情况,探讨其作为房颤早期诊断标志物的应用价值,为房颤在临床上的诊断治疗提供一些线索。
-
选取2018年9月至2019年7月于蚌埠医学院第一附属医院心内科住院治疗的81例非瓣膜性房颤病人(其中阵发性房颤38例,持续性房颤43例)纳入研究,所有病人诊断均依据2014年《美国心房颤动治疗指南》,其中男43例,女38例,年龄44~93岁。排除合并慢性感染、恶性肿瘤、自身免疫疾病、风湿性心脏病、瓣膜性房颤、急性冠状动脉综合征、脑卒中、肝肾功能损伤等严重原发性疾病及近期服用过任何抗炎药物的病人。另选取同期在我院心血管科住院的非房颤病人40例纳入对照组,其中男24例,女16例,年龄56~89岁。所有入组者均自愿签署知情同意书。
-
Cdc42和YAP含量检测均采用酶联免疫吸附法(ELISA),试剂盒由上海羽朵公司提供,检测方法根据试剂盒中的操作步骤实施。血常规、凝血等各项指标、左心房内径(LAD)和左心室射血分数(LVEF)测定分别在我院检验科和心脏超声室完成。
-
采用t(或t')检验、χ2检验、Pearson相关分析和logistic回归分析,Cdc42和YAP对房颤的诊断价值通过ROC曲线确定。
-
同对照组相比,房颤病人CRP、国家标准化比值、D-二聚体、LAD水平增高,LVEF水平降低,差异均有统计学意义(P<0.01),其余一般资料2组差异无统计学意义(P>0.05)(见表 1)。房颤病人中,持续性房颤病人较阵发性房颤病人LAD增大,LVEF降低,差异均有统计学意义(P<0.01);其余一般资料2种病人比较差异无统计学意义(P>0.05)(见表 2)。
分组 n 男性[n; 百分率(%)] 合并高血压[n; 百分率(%)] 合并糖尿病[n; 百分率(%)] 年龄/岁 白细胞/ (×109/L) 中性粒细胞/ (×109/L) 对照组 40 24(66.0) 32(80.0) 7(17.5) 69.68±9.96 11.70±6.19 7.45±1.93 房颤组 81 43(53.1) 62(76.5) 17(20.9) 71.68±9.94 12.34±6.03 7.63±1.88 t — 0.52* 0.16* 0.21* 1.04 0.54 0.49 P — >0.05 >0.05 >0.05 >0.05 >0.05 >0.05 分组 n 淋巴细胞/ (×109/L) 血小板/ (×109/L) C反应蛋白/ (mg/L) 国家标准化比值 D-二聚体/ (μg/L) LAD/mm LVEF/% 对照组 40 1.06±0.58 256.62±90.61 5.27±2.90 1.11±0.12 0.24±0.15 32.44±1.49 56.89±3.69 房颤组 81 1.01±0.61 254.51±82.17 15.41±25.68 1.26±0.44 2.43±6.08 42.35±6.35 48.83±5.55 t — 0.43 1.13 3.51△ 2.86△ 3.24△ 13.32△ 9.49 P — >0.05 >0.05 <0.01 <0.01 <0.01 <0.01 <0.01 *示χ2值;△示t'值 表 1 对照组与房颤病人基线资料比较(x±s)
分组 n 男性[n; 百分率(%)] 合并高血压[n; 百分率(%)] 合并糖尿病[n; 百分率(%)] 年龄/岁 白细胞(×109/L) 中性粒细胞(×109/L) 阵发性房颤 38 20(57.8) 29(76.3) 8(21.0) 69.47±11.03 11.92±6.27 7.56±2.06 持续性房颤 43 23(53.4) 33(76.7) 9(20.9) 73.63±8.53 12.70±5.85 7.70±1.73 t — 0.01* 0.00* 0.00* 1.91 0.58 0.33 P — >0.05 >0.05 >0.05 >0.05 >0.05 >0.05 分组 n 淋巴细胞(×109/L) 血小板(×109/L) C反应蛋白/ (mg/L) 国家标准化比值 D-二聚体/ (μg/L) LAD/mm LVEF/% 阵发性房颤 38 1.11±0.60 259.13±88.01 18.10±21.42 1.24±0.43 1.39±1.77 37.27±4.72 53.11±4.18 持续性房颤 43 0.92±0.62 250.44±77.46 13.03±28.98 1.27±0.44 3.35±8.11 46.84±3.64 45.05±3.46 t — 1.40 0.47 0.89 0.31 1.54△ 10.28 9.49 P — >0.05 >0.05 >0.05 >0.05 >0.05 <0.01 <0.01 *示χ2值;△示t'值 表 2 2种房颤病人基线资料比较(x±s)
-
同对照组相比,房颤病人血清Cdc42和YAP表达水平增高,差异有统计学意义(P<0.01)(见表 3);持续性房颤病人血清Cdc42和YAP表达水平较阵发性房颤病人升高,差异有统计学意义(P<0.01和P<0.05)(见表 4)。
分组 n YAP/(ng/mL) Cdc4/(ng/mL) 对照组 40 7.45±2.29 37.89±15.35 房颤组 81 13.58±2.45 58.31±11.42 t — 13.22 7.46* P — <0.01 <0.01 *示t'值 表 3 2组病人血清Cdc42和YAP比较(x±s)
分组 n YAP/(ng/mL) Cdc4/(ng/mL) 阵发性房颤 38 11.95±2.23 54.93±6.67 持续性房颤 43 15.03±1.58 61.29±13.77 t' — 7.09 2.69 P — <0.01 <0.05 表 4 2种房颤病人血清Cdc42和YAP比较(x±s)
-
Pearson相关性分析结果显示,房颤病人血清Cdc42和YAP水平与D-二聚体、LAD呈正相关(P<0.05~P<0.01),与CRP无相关关系(P>0.05),与左心室射血分数呈负相关(P<0.01)(见表 5)。
指标 YAP Cdc42 r P r P C反应蛋白/(mg/L) 0.117 >0.05 0.148 >0.05 INR 0.163 >0.05 0.066 >0.05 D-二聚体/(μg/L) 0.222 <0.05 0.200 <0.05 LA/mm 0.666 <0.01 0.470 <0.01 LVEF/% -0.672 <0.01 -0.479 <0.01 表 5 房颤病人血清Cdc42和YAP与各指标检测相关性
-
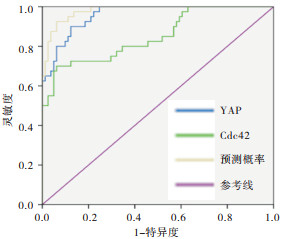
Cdc42、YAP单独诊断以及二者联合诊断灵敏度分别为90.0%、70.0%、92.5%,特异度分别为87.7%、93.8%、93.8%,ROC曲线下面积(AUC)分别为0.959、0.851、0.980。与Cdc42、YAP单独诊断相比,二者联合诊断的灵敏度、特异度以及AUC均提高(P<0.05)(见图 1)。以是否房颤为因变量(正常对照组赋值为1,房颤组赋值为2),以性别、YAP、cdc42、D-二聚体、LAD及LVEF为自变量,进行logistic回归分析,结果显示,D-二聚体、LAD、Cdc42及YAP表达增加、LVEF减小均为影响房颤的危险因素(P<0.05~P<0.01)(见表 6)。
变量 B SE Waldχ2 P OR 95.0%CI 性别 -0.350 0.757 0.00 >0.05 0.966 0.219~4.259 YAP/(ng/mL) 1.005 0.245 16.82 <0.01 2.732 1.690~4.418 Cdc42/(ng/mL) 0.171 0.050 11.81 <0.01 1.187 1.076~1.308 D-二聚体/(μg/L) 3.664 1.543 5.64 <0.05 39.009 1.896~802.551 LAD/mm 0.631 0.208 9.19 <0.01 1.880 1.250~2.827 LVEF/% -7.594 0.104 7.06 <0.01 0.785 0.618~0.930 表 6 二元logistic回归分析
-
房颤是临床上最常见的心律失常,约占因心律失常住院病人的1/3。房颤可导致病人生活质量下降,血栓栓塞,充血性心力衰竭甚至室颤猝死等严重后果,成为老年病中发病率和死亡率高的主要因素之一,房颤的防治已成为目前老龄化社会重要的公共卫生问题[8-10]。房颤是一种多机制参与的疾病,且目前针对房颤的诊断尚缺乏有效血清学指标,本研究试图通过分析Cdc42和YAP在房颤病人和健康人群表达水平的差异,寻求Cdc42和YAP表达同房颤发生机制之间的联系,以期为房颤的早期诊断寻找新的分子标志物。
在本实验中,在最初排除了抗炎药及慢性感染、急性冠状动脉综合征、脑卒中等疾病可能对此造成的影响,我们发现房颤组病人血清中的CRP、D-二聚体水平显著高于对照组,logistic回归的结果也表明D-二聚体为影响房颤的危险因素,也间接验证了高凝性有助于房颤基质发育的假说[11],与文献[12-13]中报道的房颤病人血清中炎症及止血标志物显著升高的结果相似。但在房颤病人中这些指标差异无统计学意义,这或与纳入研究的样本量较小,或存在偏倚有关。事实上,房颤病人血液的高凝状态与炎症密切相关同时也是脑卒中和血栓栓塞发生的风险因素,炎症反应的介质可改变心房电生理和结构底物,从而增加房颤的易感性[14],因此CRP及D-二聚体展现的更多的是在房颤病人发生血栓相关事件风险的潜在预测价值。心房重构是近年来研究较多的房颤发病机制之一,心房重构主要包括两种类型:结构重构和电重构。心房结构重构是指心肌细胞发生表型变化、体积改变及收缩蛋白表达改变等病理改变外,心房间质成纤维细胞也发生活化、增殖,诱发严重的局部传导阻滞及结构紊乱(胶原重构),形成折返,促进房颤的发生[15]。左心房作为左心室和肺循环之间的分水岭,起到调节左心室血液充盈的作用,LAD与LVEF密切相关,LAD增大作为左心房重构的标志在房颤的发生发展中也起到不可忽视的作用[16-18]。我们的研究同时观察到,房颤病人LAD较对照组明显增大,LVEF减小,而持续性房颤病人中该现象较阵发性房颤病人更为显著,回归分析中也显示LAD同LVEF均为影响房颤的因素。综上,我们认为LAD及LVEF水平的变化或有助于帮助我们判断心房重构的严重程度[18-19]。
Cdc42可诱导细胞骨架的重组和信号级联的激活,最终控制细胞的黏附、迁移、增殖、存活、分化、凋亡和基因表达,有利于细胞外基质(extracellular matrix,ECM)的稳态和结缔组织的完整性[20],而心房组织ECM失衡是心房重构的重要原因。CHEN等[21]团队的研究提示Cdc42所在的Rho/Rock信号通路参与了糖尿病大鼠心房纤维化的发生。YAP作为哺乳动物的同源蛋白,是器官生长的关键驱动因素,可调节细胞周期蛋白和microRNA的表达,促进细胞增殖,抑制细胞凋亡,YAP及其所在的Hippo级联通路已被证明对正常心脏发育至关重要[7, 22]。多项研究[23-24]结果也证实YAP可通过不同途径刺激心肌细胞增殖、存活,具有促肥大、促生存的功能。
目前,房颤的诊断缺少直接评估指标,在本实验中,我们观察到房颤病人血清中Cdc42和YAP水平表达显著高于非房颤病人,且二者表达水平均与房颤严重程度密切相关,结合以上文献中的各项报道说明Cdc42和YAP或通过调控心肌细胞的增殖凋亡影响心房重构参与房颤的发病。此外,Pearson相关分析结果显示Cdc42和YAP与D-二聚体、LAD、LVEF都有很好的相关性,从侧面验证了Cdc42和YAP作为房颤诊断的生物标志物的潜在价值。本研究结果显示,Cdc42、YAP单独诊断房颤的发生具有一定的灵敏度和特异度,二者联合诊断时灵敏度和特异度显著提高且AUC显著增加,提示Cdc42、YAP联合检测对于房颤的诊断更有参考价值。在房颤的众多发病机制中,心房纤维化可引起传导异质性和自主神经重构促使房颤更易发作和维持[25],logistic回归分析结果提示我们Cdc42、YAP为影响房颤发生的相关因素。无论是Cdc42涉及对心肌细胞存亡的调控,还是YAP对心脏发育的影响都与心房纤维化有着密切联系,因此血清中Cdc42、YAP的变化早于房颤临床表现的出现,有一定的预测价值。
综上所述,房颤病人Cdc42和YAP均异常表达,与房颤的发生有一定的关联性,未来可深入研究Cdc42、YAP在房颤中的作用机制,并结合其他一些指标,以期为房颤作更准确的诊断,更可为房颤的治疗寻求有意义的药物作用靶点。
Cdc42及YAP检测对非瓣膜性心房颤动诊断的相关性研究
Correlation between Cdc42 and YAP in the diagnosis of nonvalvular atrial fibrillation
-
摘要:
目的探讨非瓣膜性心房颤动(房颤)病人血清细胞分裂周期蛋白42(Cdc42)和转录辅助激活因子Yes相关蛋白(YAP)表达水平及临床意义。 方法选取81例非瓣膜性房颤病人(其中阵发性房颤38例,持续性房颤43例)为研究对象,40例同期住院非房颤病人为对照组,采用酶联免疫吸附法检测血清Cdc42及YAP表达水平。同时结合相关血清学指标,统计分析非瓣膜性房颤病人的Cdc42及YAP水平,探讨两者与非瓣膜性房颤诊断的关系。 结果同对照组相比,房颤病人CRP、国家标准化比值、D-二聚体、LAD水平增高,LVEF水平降低,差异有统计学意义(P < 0.01),房颤病人中,持续性房颤病人较阵发性房颤病人LAD增大,LVEF降低,差异有统计学意义(P < 0.01);同对照组相比,房颤病人血清Cdc42和YAP表达水平增高,差异有统计学意义(P < 0.01),持续性房颤病人血清Cdc42和YAP表达水平较阵发性房颤病人升高,差异有统计学意义(P < 0.01和P < 0.05)。Pearson相关性分析结果显示,房颤病人血清Cdc42和YAP水平与D-二聚体、LAD呈正相关(P < 0.05~P < 0.01),与左心室射血分数呈负相关(P < 0.01);Cdc42及YAP二者联合诊断房颤的受试者工作特征曲线下面积较单独诊断提高(P < 0.05)。D-二聚体、LAD、Cdc42及YAP表达增加、LVEF减小均为影响房颤的危险因素(P < 0.05~P < 0.01)。 结论房颤病人血清Cdc42及YAP异常表达,可能参与房颤心房结构重构的发生发展,可用作早期潜在辅助诊断房颤的指标。 -
关键词:
- 心房颤动 /
- 心房纤维化 /
- 细胞分裂周期蛋白42 /
- Yes相关蛋白
Abstract:ObjectiveTo investigate the serum expression levels of cell division cyclin 42(Cdc42) and transcription-assisted activator Yes-associated protein(YAP) in patients with non-valvular atrial fibrillation, and its clinical significance. MethodsEighty-one patients with non-valvular atrial fibrillation(including 38 patients with paroxysmal atrial fibrillation and 43 patients with persistent atrial fibrillation) were selected, and 40 patients with non-atrial fibrillation at the same time were set as the control group.The serum levels of Cdc42 and YAP of patients with non-valvular atrial fibrillation were detected using ELISA, and statistically analyzed in combination with related serological indexes.The relationship between the levels of Cdc42 and YAP and diagnosis of non-valvular atrial fibrillation were investigated. ResultsCompared with the control group, the levels of CRP, national standardized ratio, D-dimer and LAD increased, the LVEF level decreased, and the differences of which were statistically significant(P < 0.01).Compared with patients with paroxysmal atrial fibrillation, the level of LAD increased, the level of left ventricular ejection fraction(LVEF) decreased in patients with persistent atrial fibrillation, and the differences of which were statistically significant(P < 0.01).Compared with the control group, the serum levels of Cdc42 and YAP increased in patients with atrial fibrillation, and the differences of which were statistically significant(P < 0.01).Compared with patients with paroxysmal atrial fibrillation, the serum levels of Cdc42 and YAP increased in patients with persistent atrial fibrillation, and the differences of which were statistically significant(P < 0.01).The results of Pearson correlation analysis showed that the serum levels of Cdc42 and YAP were positively correlated with the levels of D-dimer and LAD in patients with atrial fibrillation(P < 0.05 to P < 0.01), and negatively correlated with LVEF(P < 0.01).The area under ROC curve of the combined diagnosis of atrial fibrillation with Cdc42 and YAP was significantly higher than that of the single diagnosis(P < 0.05).The expression levels of D-dimer, LAD, Cdc42 and YAP increasing and LVEF level dereasing were the risk factors of arial fibrillation(P < 0.05 to P < 0.01). ConclusionsAbnormal expression of serum Cdc42 and YAP in patients with atrial fibrillation may be involved in the occurrence and development of atrial remodeling in atrial fibrillation, and which can be used as a potential indicator for the early diagnosis of atrial fibrillation. -
Key words:
- atrial fibrillation /
- atrial fibrosis /
- cell division cyclin 42 /
- Yes-associated protein
-
表 1 对照组与房颤病人基线资料比较(x±s)
分组 n 男性[n; 百分率(%)] 合并高血压[n; 百分率(%)] 合并糖尿病[n; 百分率(%)] 年龄/岁 白细胞/ (×109/L) 中性粒细胞/ (×109/L) 对照组 40 24(66.0) 32(80.0) 7(17.5) 69.68±9.96 11.70±6.19 7.45±1.93 房颤组 81 43(53.1) 62(76.5) 17(20.9) 71.68±9.94 12.34±6.03 7.63±1.88 t — 0.52* 0.16* 0.21* 1.04 0.54 0.49 P — >0.05 >0.05 >0.05 >0.05 >0.05 >0.05 分组 n 淋巴细胞/ (×109/L) 血小板/ (×109/L) C反应蛋白/ (mg/L) 国家标准化比值 D-二聚体/ (μg/L) LAD/mm LVEF/% 对照组 40 1.06±0.58 256.62±90.61 5.27±2.90 1.11±0.12 0.24±0.15 32.44±1.49 56.89±3.69 房颤组 81 1.01±0.61 254.51±82.17 15.41±25.68 1.26±0.44 2.43±6.08 42.35±6.35 48.83±5.55 t — 0.43 1.13 3.51△ 2.86△ 3.24△ 13.32△ 9.49 P — >0.05 >0.05 <0.01 <0.01 <0.01 <0.01 <0.01 *示χ2值;△示t'值 表 2 2种房颤病人基线资料比较(x±s)
分组 n 男性[n; 百分率(%)] 合并高血压[n; 百分率(%)] 合并糖尿病[n; 百分率(%)] 年龄/岁 白细胞(×109/L) 中性粒细胞(×109/L) 阵发性房颤 38 20(57.8) 29(76.3) 8(21.0) 69.47±11.03 11.92±6.27 7.56±2.06 持续性房颤 43 23(53.4) 33(76.7) 9(20.9) 73.63±8.53 12.70±5.85 7.70±1.73 t — 0.01* 0.00* 0.00* 1.91 0.58 0.33 P — >0.05 >0.05 >0.05 >0.05 >0.05 >0.05 分组 n 淋巴细胞(×109/L) 血小板(×109/L) C反应蛋白/ (mg/L) 国家标准化比值 D-二聚体/ (μg/L) LAD/mm LVEF/% 阵发性房颤 38 1.11±0.60 259.13±88.01 18.10±21.42 1.24±0.43 1.39±1.77 37.27±4.72 53.11±4.18 持续性房颤 43 0.92±0.62 250.44±77.46 13.03±28.98 1.27±0.44 3.35±8.11 46.84±3.64 45.05±3.46 t — 1.40 0.47 0.89 0.31 1.54△ 10.28 9.49 P — >0.05 >0.05 >0.05 >0.05 >0.05 <0.01 <0.01 *示χ2值;△示t'值 表 3 2组病人血清Cdc42和YAP比较(x±s)
分组 n YAP/(ng/mL) Cdc4/(ng/mL) 对照组 40 7.45±2.29 37.89±15.35 房颤组 81 13.58±2.45 58.31±11.42 t — 13.22 7.46* P — <0.01 <0.01 *示t'值 表 4 2种房颤病人血清Cdc42和YAP比较(x±s)
分组 n YAP/(ng/mL) Cdc4/(ng/mL) 阵发性房颤 38 11.95±2.23 54.93±6.67 持续性房颤 43 15.03±1.58 61.29±13.77 t' — 7.09 2.69 P — <0.01 <0.05 表 5 房颤病人血清Cdc42和YAP与各指标检测相关性
指标 YAP Cdc42 r P r P C反应蛋白/(mg/L) 0.117 >0.05 0.148 >0.05 INR 0.163 >0.05 0.066 >0.05 D-二聚体/(μg/L) 0.222 <0.05 0.200 <0.05 LA/mm 0.666 <0.01 0.470 <0.01 LVEF/% -0.672 <0.01 -0.479 <0.01 表 6 二元logistic回归分析
变量 B SE Waldχ2 P OR 95.0%CI 性别 -0.350 0.757 0.00 >0.05 0.966 0.219~4.259 YAP/(ng/mL) 1.005 0.245 16.82 <0.01 2.732 1.690~4.418 Cdc42/(ng/mL) 0.171 0.050 11.81 <0.01 1.187 1.076~1.308 D-二聚体/(μg/L) 3.664 1.543 5.64 <0.05 39.009 1.896~802.551 LAD/mm 0.631 0.208 9.19 <0.01 1.880 1.250~2.827 LVEF/% -7.594 0.104 7.06 <0.01 0.785 0.618~0.930 -
[1] SOHNS C, MARROUCHE NF. Atrial fibrillation and cardiac fibrosis[J]. Eur Heart J, 2020, 41(10): 1123. doi: 10.1093/eurheartj/ehz786 [2] ZIMETBAUM P. Atrial Fibrillation[J]. Ann Intern Med, 2017, 166(5): ITC33. doi: 10.7326/AITC201703070 [3] ASPENSTRÖM P, FRANSSON A, SARAS J. Rho GTPases have diverse effects on the organization of the actin filament system[J]. Biochem J, 2004, 377(2): 327. doi: 10.1042/bj20031041 [4] SVENJA H, RIDLEY AJ, SUSANNE L. The function of Rho-associated kinases ROCK1 and ROCK2 in the pathogenesis of cardiovascular disease[J]. Front Pharmacol, 2015, 6: 276. doi: 10.3389/fphar.2015.00276/pdf [5] RAUT SK, KUMAR A, SINGH GB, et al. miR-30c mediates upregulation of Cdc42 and Pak1 in diabetic cardiomyopathy[J]. Cardiovasc Ther, 2015, 33(3): 89. doi: 10.1111/1755-5922.12113 [6] LI J, GAO E, VITE A, et al. Alpha-catenins control cardiomyocyte proliferation by regulating Yap activity[J]. Circ Res, 2015, 116(1): 70. doi: 10.1161/CIRCRESAHA.116.304472 [7] LIN ZQ, GUO HD, CAO Y, et al. Acetylation of VGLL4 regulates Hippo-YAP signaling and postnatal cardiac growth[J]. Dev Cell, 2016, 39(4): 466. doi: 10.1016/j.devcel.2016.09.005 [8] ROBERTS JD, GOLLOB MH. Impact of genetic discoveries on the classification of lone atrial fibrillation[J]. J Am CollCardiol, 2010, 55(8): 705. doi: 10.1016/j.jacc.2009.12.005 [9] LIP GY, TSE HF. Management of atrial fibrillation[J]. Lancet, 2007, 370(9587): 604. doi: 10.1016/S0140-6736(07)61300-2 [10] 单锋, 葛敏, 唐碧, 等. 二十二碳六烯酸对房颤大鼠心房纤维化的影响[J]. 蚌埠医学院学报, 2018, 43(4): 444. [11] LIN Z, PU WT. Releasing YAP From an α-catenin trap increases cardiomyocyte proliferation[J]. Circ Res, 2015, 116(1): 9. doi: 10.1161/CIRCRESAHA.114.305496 [12] LIP GY, PATEL JV, HUGHES E, et al. High-sensitivity C-reactive protein and soluble CD40 ligand as indices of inflammation and platelet activation in 880 patients with nonvalvular atrial fibrillation relationship to stroke risk factors, stroke risk stratification schema, and prognosis[J]. Stroke, 2007, 38(4): 1229. doi: 10.1161/01.STR.0000260090.90508.3e [13] WU N, CHEN X, CAI T, et al. Association of inflammatory and hemostatic markers with stroke and thromboembolic events in atrial fibrillation: asystematic review and meta-analysis[J]. Can J Cardiol, 2015, 31(3): 278. doi: 10.1016/j.cjca.2014.12.002 [14] SPRONK HM, DE JONG AM, VERHEULE S, et al. Hypercoagulability causes atrial fibrosis and promotes atrial fibrillation[J]. Eur Heart J, 2017, 38(1): 38. doi: 10.1093/eurheartj/ehw119 [15] STAERK L, SHERER JA, KO D, et al. Atrial fibrillation: epidemiology, pathophysiology, and clinical outcomes[J]. Circ Res, 2017, 120(9): 1501. doi: 10.1161/CIRCRESAHA.117.309732 [16] MELENOVSKY V, HWANG SJ, REDFIELD MM, et al. Left atrial remodeling and function in advanced heart failure with preserved or reduced ejection fraction[J]. Circ Heart Fail, 2015, 8(2): 295. doi: 10.1161/CIRCHEARTFAILURE.114.001667 [17] ZHU N, CHEN H, ZHAO X, et al. Left atrial diameter in heart failure with left ventricular preserved, mid-range, and reduced ejection fraction[J]. Medicine(Baltimore), 2019, 98(48): e18146. [18] LEE HL, HWANG YT, CHANG PC, et al. A three-year longitudinal study of the relation between left atrial diameter remodeling and atrial fibrillation ablation outcome[J]. J Geriatr Cardiol, 2018, 15(7): 486. [19] AKKAYA M, HIGUCHI K, KOOPMANN M, et al. Higher degree of left atrial structural remodeling in patients with atrial fibrillation and left ventricular systolic dysfunction[J]. J Cardiovasc Electrophysiol, 2013, 24(5): 485. doi: 10.1111/jce.12090 [20] DEROANNE CF, HAMELRYCKX D, HO TT, et al. Cdc42 downregulates MMP-1 expression by inhibiting the ERK1/2 pathway[J]. J Cell Sci, 2005, 118(Pt6): 1173. [21] CHEN JL, LI QQ, DONG RP, et al. The effect of the Ras homolog gene family(Rho), member A/Rho associated coiled-coil forming protein kinase pathway in atrial fibrosis of type 2 diabetes in rats[J]. Exp Ther Med, 2014, 8(3): 836. doi: 10.3892/etm.2014.1843 [22] YANG Y, DEL RE PD, NAKANO N, et al. miR-206 mediates YAP-induced cardiac hypertrophy and survival[J]. Circ Res, 2015, 117(10): 891. [23] LIN ZQ, ZHOU PZ, VON GISE A, et al. Pi3kcb links Hippo-YAP and PI3K-AKT signaling pathways to promote cardiomyocyte proliferation and survival[J]. Circ Res, 2015, 116(1): 35. doi: 10.1161/CIRCRESAHA.115.304457 [24] HU YF, CHEN YJ, LIN YJ, et al. Inflammation and the pathogenesis of atrial fibrillation[J]. Nat Rev Cardiol, 2015, 12(4): 230. doi: 10.1038/nrcardio.2015.2 [25] DVZEN IV, YAVUZ F, VURUSKAN E, et al. Investigation of leukocyte RHO/ROCK gene expressions in patients with non-valvular atrial fibrillation[J]. Exp Ther Med, 2019, 18(4): 2777. -





 下载:
下载: