-
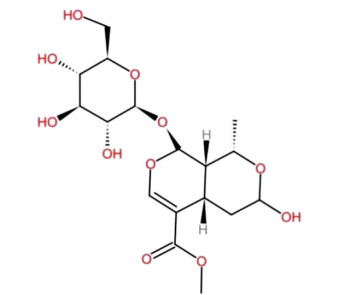
中国传统医药历经几千余年的发展和沉淀,为现代医学提供了大量经实践证明具有临床药用价值的天然植物类药物。伴随着青蒿素在抗疟疾治疗中取得的巨大成就,越来越多的学者投入到了对中草药有效成分的研究[1]。莫诺苷(morroniside)是一种从山茱萸或接骨木成熟果肉中提纯的环烯醚萜苷类化合物。莫诺苷纯化物为白色结晶粉末,分子式C17H26O11,相对分子质量为406.381 7(分子结构式见图 1)。作为一种小分子单体化合物,莫诺苷被证实具有抗炎、抗凝、抗凋亡、抗氧化应激和促进修复等多种生物学活性,其药用价值备受瞩目。本文就莫诺苷的分子结构和制取、药理学作用机制、药理作用的中医解释等方面进行文献综述,以期为该领域的研究提供参考。
多项前期基础和临床研究显示莫诺苷对炎症、脑缺血、糖尿病、胃肠疾病、骨折愈合等疾病或病理过程具有治疗或改善作用,呈现出较强的临床应用潜力。由于生物学功能多样,莫诺苷的药理学机制尚未完全阐明,目前对其拮抗炎症、清除氧自由基等分子机制的研究相对充分。莫诺苷的药理学作用和机制分述如下。
-
炎症是多种疾病的共同病理生理过程,现已明确莫诺苷在脑缺血炎症反应、心肌梗死后炎症反应、慢性消化道炎症反应中均呈现不同程度的抗炎保护作用[2-5]。
中枢神经系统(脑或脊髓)损伤后,局部浸润的小胶质细胞、星型胶质细胞和白细胞所分泌的大量炎症介质可引发组织的二次损伤,是影响病人预后的关键因素[6]。在众多的炎症介质中白细胞介素(interleukin,IL)-1β扮演关键角色,IL-1β可协同其他炎症介质促进B淋巴细胞、T淋巴细胞活化,诱导巨噬细胞浸润,启动炎症级联放大过程[5]。有学者在脑缺血再灌注动物模型中观察到IL-1β与脑组织损伤的程度有关,而阻断IL-1β可减少脑梗死面积[7]。莫诺苷能够抑制大鼠脑缺血组织中IL-1β的表达,从而抑制炎症反应,保护神经功能[8]。此外,在脑出血大鼠模型的研究中发现,莫诺苷可通过抑制核因子-κB(nuclear factor-kappaB,NF-κB)信号通路,抑制下游IL-1β和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的表达,从而抑制过度激活的炎症反应[9]。
心肌梗死后心肌细胞凋亡是导致心脏功能进一步丧失的关键病理环节,而炎症是诱发心肌细胞凋亡的主要因素之一[10]。此外,心肌梗死后炎症反应还是引发心肌纤维化的关键因素[11]。在大鼠心肌梗死的研究中发现,莫诺苷可剂量依赖性减少心肌梗死面积,抑制心肌局部IL-8、IL-17等促炎介质的表达[12];同时,莫诺苷还可调控转化生长因子-β/SMAD(drosophila mothers against decapentaplegic)信号通路,减轻心肌梗死后心肌纤维化的程度[12]。
溃疡性结肠炎(ulcerative colitis,UC)是一种结直肠非特异性、炎症性疾病,抑制肠黏膜炎症介质水平是当前的主要治疗方式。研究[4]显示肠黏膜IL-1β、IL-6和TNF-α等炎症介质水平和UC的疾病活动程度呈显著正相关,而信号转导与转录激活因子(signal transducer and activator of transcription,STAT)3/NF-κB/IL-6信号是参与调控UC炎症的关键通路。在UC小鼠模型的研究中发现,莫诺苷可显著抑制肠炎小鼠肠黏膜STAT3的磷酸化,下调STAT3/ NF-κB/IL-6信号通路,从而改善肠道炎症[13]。
胃黏膜持续慢性炎症和上皮过度凋亡被证实是慢性萎缩性胃炎(chronic atrophic gastritis,CAG)发病机制之一[14]。研究[3]表明,莫诺苷可显著抑制CAG小鼠胃黏膜NF-κB p65信号通路,抑制下游TNF-α、IL-6和IL-1β水平,发挥抗炎作用;此外,其还可通过促进抗凋亡蛋白表达,抑制Bax、caspase-3和caspase-9的表达,从而发挥抗胃黏膜上皮细胞凋亡作用。
可见,莫诺苷在多种炎症相关病理过程中,可通过下调促炎信号通路和/或抑制炎症介质表达的方式发挥其拮抗炎症反应的功能。
-
氧化应激(oxidative stress,OS)是多种病理过程中组织损伤的重要因素[15]。新近的研究显示Kelch样ECH联合蛋白1(Keap1 Kelch-like ECH-associated protein1,Keep1)/红系衍生的核转录相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)信号在OS过程中发挥保护性作用,其下游表达的血红素氧合酶-1(heme oxygenase 1,HO-1)、醌氧化还原酶1(quinone oxidoreductase 1,NQO1)和超氧化物歧化酶(superoxide dismutase,SOD)等具有直接拮抗氧自由基的作用[16]。
周玉燕等[17]研究发现莫诺苷可通过上调Keep1/Nfr2信号,从而拮抗雷公藤甲素诱导的肝细胞氧化应激损伤。在心肌细胞氧化应激损伤的研究中,莫诺苷也被证实可通过上调Keep1/Nrf2信号,促进SOD、HO-1表达,抑制丙二醛表达,从而发挥保护心肌的作用[18]。在缺血、缺氧诱导的脑组织氧化应激损伤的研究中,莫诺苷被先后证实可通过上调Keep1/Nrf2信号拮抗氧化应激诱导的神经细胞坏死、凋亡和炎性损伤[19-20]。
由此可见,莫诺苷在多种疾病模型中的抗氧化应激损伤作用是明确的,主要作用机制是激活Keep1/Nrf2信号,其是否为Nrf2信号的天然激动剂有待于进一步研究。
-
糖尿病在我国的发病率呈现逐年升高趋势,其并发症可涉及心血管、肾脏等全身多个系统,是一种严重威胁健康的慢性、代谢性疾病。有研究显示莫诺苷可通过拮抗晚期糖基化终产物(advanced glycosylation endproduct, AGE)的产生,以及拮抗氧化应激等途径,改善糖尿病“三多一少”症状和高糖引发的肾脏损伤[21-22]。此外,AGE信号激活可抑制骨髓间充质干细胞的成骨分化,是糖尿病性骨质疏松症的发病机制之一,莫诺苷可拮抗AGE信号从而抑制糖尿病性骨质疏松症[23]。糖尿病相关性心肌损伤是导致病人心力衰竭的重要因素之一[24],莫诺苷可拮抗高糖诱发的心肌细胞氧化应激损伤和炎性损伤,从而保护心脏功能[25]。
可见,莫诺苷对糖尿病脏器损伤具有保护作用,但具体机制仍然有待进一步探索。
-
除拮抗氧化应激和炎症,间接保护病理状态下神经细胞损伤外,莫诺苷被证实对神经细胞具有直接保护性作用。Wnt信号通路是调控细胞生长增殖分化、神经发生的关键途径,其中Wnt7a可促进轴突微管重构、轴突扩展及分支;也可促进小脑皮层中小脑粒细胞和苔藓纤维之间突触连接的成熟,从而提高皮质层神经细胞分化以及前体细胞自我更新能力[31]。在脑缺血再灌注大鼠模型的研究中发现,莫诺苷可通过激活Wnt7a而促进脑神经细胞的修复,改善神经功能[32]。同时,莫诺苷通过抑制基质金属蛋白酶的表达,减少细胞外基质的降解,保护血脑屏障的完整性[33]。此外,莫诺苷可通过调控丝裂原活化蛋白激酶、腺苷酸活化蛋白激酶和线粒体自噬等途径,增强神经元细胞拮抗缺氧、缺糖性损伤,减少神经元细胞凋亡[34-35]。
-
利用现代科技对中草药进行提取纯化、分析研究,阐明其化学物质基础,是实现中药现代化必由之路。近几年,莫诺苷逐渐成为备受关注的“明星”分子,对其的研究也在不断丰富,除了分子机制的研究外,也有更多的临床应用观察。但其研究的短板仍然十分明显:(1)基础研究多聚焦在细胞、动物模型层次,多数为不同细胞、不同动物、不同模型的低水平重复,未能进行更广更深的系统性研究;(2)临床药理作用的研究多为单中心、小样本的观察或描述性探讨,需要推动设计良好、多中心、前瞻性的大规模临床研究;(3)宜更多聚焦不同应用领域基础科研,提升临床应用的基础药理学阐释,着眼研究和应用的深度和广度。由于莫诺苷显示出丰富的生物学活性,相信随着基础及临床研究不断推进,其相关分子机制被不断揭示,莫诺苷一定会展现出令人期待的临床应用前景。
莫诺苷药理学作用和机制的研究进展
-
-
[1] SU XZ, MILLER LH. The discovery of artemisinin and the Nobel Prize in Physiology or Medicine[J]. Sci China Life Sci, 2015, 58(11): 1175. doi: 10.1007/s11427-015-4948-7 [2] 杨炳友, 刘艳, 林晓影, 等. 莫诺苷对TNF-α诱导MC3T3-E1细胞炎症的保护作用及机制研究[J]. 中草药, 2018, 49(16): 3776. [3] ZHANG J, WANG H. Morroniside protects against chronic atrophic gastritis in rat via inhibiting inflammation and apoptosis[J]. Am J Transl Res, 2019, 11(9): 6016. [4] 王康, 缪志伟, 董筠, 等. 基于STAT3/NF-κB/IL-6通路研究加味黄芩汤治疗溃疡性结肠炎的作用[J]. 南方医科大学学报, 2020, 40(2): 196. [5] XIE D, GE X, MA Y, et al. Clemastine improves hypomyelination in rats with hypoxic-ischemic brain injury by reducing microglia-derived IL-1βvia P38 signaling pathway[J]. J Neuroinflammation, 2020, 17(1): 57. doi: 10.1186/s12974-019-1662-6 [6] FRINGUELLO A, TATMAN PD, WROBLEWSKI T, et al. Cytokine-laden extracellular vesicles predict patient prognosis after cerebrovascular accident[J]. Int J Mol Sci, 2021, 22(15): 7847. doi: 10.3390/ijms22157847 [7] MENG C, ZHANG J, ZHANG L, et al. Effects of NLRP6 in cerebral ischemia/reperfusion (I/R) injury in rats[J]. J Mol Neurosci, 2019, 69(3): 411. doi: 10.1007/s12031-019-01370-4 [8] 张丽, 孙芳玲, 艾厚喜, 等. 莫诺苷对大鼠脑缺血再灌注大鼠皮层IL-1β的影响[J]. 中国药理学与毒理学杂志, 2012, 6(3): 424. [9] 袁志俊, 何晓英, 袁平, 等. 莫诺苷通过抑制炎症反应改善脑出血模型大鼠的神经功能[J]. 中国组织工程研究, 2018, 22(08): 1217. [10] VAFADARNEJAD E, RIZZO G, KRAMPERT L, et al. Dynamics of cardiac neutrophil diversity in murine myocardial infarction[J]. Circ Res, 2020, 127(9): 232. [11] LIU Y, XU J, WU M, et al. The effector cells and cellular mediators of immune system involved in cardiac inflammation and fibrosis after myocardial infarction[J]. J Cell Physiol, 2020, 235(12): 8996. doi: 10.1002/jcp.29732 [12] 陈志良, 申朝辉, 李爽. 莫诺苷对心肌梗死模型大鼠心肌纤维化的改善及作用机制研究[J]. 临床和实验医学杂志, 2021, 20(06): 584. doi: 10.3969/j.issn.1671-4695.2021.06.007 [13] YUAN J, CHENG W, ZHANG G, et al. Protective effects of iridoid glycosides on acute colitis via inhibition of the inflammatory response mediated by the STAT3/NF-кB pathway[J]. Int Immunopharmacol, 2020, 81: 106240. doi: 10.1016/j.intimp.2020.106240 [14] NEUMANN WL, COSS E, RUGGE M, et al. Autoimmune atrophic gastritis--pathogenesis, pathology and management[J]. Nat Rev Gastroenterol Hepatol, 2013, 10(9): 529. doi: 10.1038/nrgastro.2013.101 [15] MATYAS C, HASKÓ G, LIAUDET L, et al. Interplay of cardiovascular mediators, oxidative stress and inflammation in liver disease and its complications[J]. Nat Rev Cardiol, 2021, 18(2): 117. doi: 10.1038/s41569-020-0433-5 [16] LU MC, JI JA, JIANG ZY, et al. The Keap1-Nrf2-ARE pathway as a potential preventive and therapeutic target: An update[J]. Med Res Rev, 2016, 36(5): 924. doi: 10.1002/med.21396 [17] 周玉燕, 孙玉, 李萍, 等. 莫诺苷通过抗氧化应激保护雷公藤甲素所致肝细胞凋亡[J]. 南方医科大学学报, 2018, 38(8): 949. [18] 周景昱, 张亮, 雷晓玲, 等. 莫诺苷对缺氧缺血性脑损伤新生大鼠心肌损伤和氧化应激的保护作用[J]. 解剖学研究, 2019, 41(4): 256. [19] WANG W, SUN F, AN Y, et al. Morroniside protects human neuroblastoma SH-SY5Y cells against hydrogen peroxide-induced cytotoxicity[J]. Eur J Pharmacol, 2009, 613(1/3): 19. [20] 李江涛, 尹永锋, 王润青, 等. 莫诺苷介导Nrf2通路对HIBI模型大鼠的抗氧化和神经保护作用[J]. 安徽医科大学学报, 2021, 56(3): 374. [21] MA W, WANG KJ, CHENG CS, et al. Bioactive compounds from Cornus officinalis fruits and their effects on diabetic nephropathy[J]. J Ethnopharmacol, 2014, 153(3): 840. doi: 10.1016/j.jep.2014.03.051 [22] 吕兴, 许惠琴, 刘斌, 等. 莫诺苷对晚期糖基化终末产物加重链脲佐菌素诱导糖尿病肾病保护作用及其机制[J]. 中草药, 2014, 45(21): 3109. [23] SUN Y, ZHU Y, LIU X, et al. Morroniside attenuates high glucose-induced BMSC dysfunction by regulating the Glo1/AGE/RAGE axis[J]. Cell Prolif, 2020, 53(8): e12866. [24] JIA G, HILL MA, SOWERS JR. Diabetic cardiomyopathy: An update of mechanisms contributing to this clinical entity[J]. Circ Res, 2018, 122(4): 624. [25] CHENG YC, CHU LW, CHEN JY, et al. Loganin attenuates high glucose-induced schwann cells pyroptosis by inhibiting ROS generation and NLRP3 inflammasome activation[J]. Cells, 2020, 9(9): 1948. [26] I T, UEDA Y, WÖRSDÖRFER P, et al. Resident CD34-positive cells contribute to peri-endothelial cells and vascular morphogenesis in salivary gland after irradiation[J]. J Neural Transm (Vienna), 2020, 127(11): 1467. [27] 王志敏, 孙芳玲, 刘婷婷, 等. 莫诺苷对局灶性脑缺血再灌注大鼠皮层CD(34)表达的影响[J]. 中国康复理论与实践, 2016, 22(1): 27. [28] 刘婷婷, 孙芳玲, 程华, 等. 莫诺苷对局灶性脑缺血再灌注大鼠血管生成素1及其受体Tie-2的影响[J]. 中国康复理论与实践, 2015, 21(1): 9. [29] 艾厚喜, 孙芳玲, 王晓峰, 等. 莫诺苷对局灶性脑缺血再灌注大鼠模型红细胞压积的影响[J]. 中国康复理论与实践, 2014, 20(3): 230. [30] 程华, 孙芳玲, 王晓锋, 等. 莫诺苷对二磷酸腺苷诱导局灶性脑缺血再灌注大鼠血小板聚集的影响[J]. 中国康复理论与实践, 2013, 19(2): 101. [31] HAM O, JIN YB, KIM J, et al. Blood vessel formation in cerebral organoids formed from human embryonic stem cells[J]. Biochem Biophys Res Commun, 2020, 521(1): 84. [32] 薛金龙, 孙芳玲, 刘婷婷, 等. 莫诺苷对局灶性脑缺血再灌注大鼠Wnt7a和APC表达的影响[J]. 中国比较医学杂志, 2014, 24(9): 9. [33] 向本旭, 孙芳玲, 刘婷婷, 等. 莫诺苷对缺血再灌注大鼠皮层TIMP表达的影响[J]. 中国比较医学杂志, 2016, 26(1): 1. [34] CHEN K, LU Y, LIU C, et al. Morroniside prevents H2O2 or Aβ1-42-induced apoptosis via attenuating JNK and p38 MAPK phosphorylation[J]. Eur J Pharmacol, 2018, 834: 295. [35] 王明洋, 牛红妹, 张丽, 等. 莫诺苷对大鼠原代皮层神经元氧糖剥夺模型线粒体质量控制体系的影响[J]. 中国药理学通报, 2020, 36(9): 1221. [36] ZHOU L, WANG H, JING J, et al. Morroniside regulates hair growth and cycle transition via activation of the Wnt/β-catenin signaling pathway[J]. Sci Rep, 2018, 8(1): 13785. -





 下载:
下载: