-
动脉粥样硬化(atherosclerosis,AS)是威胁人类健康的慢性心血管疾病之一,是一种由多种因素引起的血管性疾病,AS的发生发展过程受慢性炎症和免疫机制的调控,已经成为全国乃至全球致死率较高的疾病之一[1-2]。AS是以高脂血症和血管内斑块形成为主要特征的慢性疾病。传统致AS因素如高血压、高血糖、高血脂、肥胖等不能准确评价并解释AS的发生机制,有关AS的自身免疫因素近年来受到广泛关注[3-5]。许多自身免疫性疾病如抗磷脂综合征(antiphospholipid syndrome,APS)等常伴有AS的并发,甚至会加速AS的进展,其中抗β2糖蛋白Ⅰ抗体(anti-β2-glycoprotein Ⅰantibody,抗β2GPⅠ抗体)是APS主要致病性抗体,其可以与其相应抗原β2GPⅠ结合形成复合物,加速巨噬细胞摄取氧化型低密度脂蛋白(oxidized low-density lipoprotein,oxLDL),促进泡沫细胞的形成,加速AS的进展[6-7]。内质网应激(endoplasmic reticulum stress,ERS)是各种原因导致的细胞内质网功能紊乱使蛋白质错误折叠、未折叠蛋白堆积等发生的病理过程,适度的ERS可以对机体起到保护作用,但是过度的ERS则会引起内环境紊乱,导致一系列疾病的发生,相关研究[7-8]证实ERS与AS的发生有关,抗β2GPⅠ抗体与ERS的关系如何?是否通过ERS的激活而导致巨噬细胞源性泡沫细胞形成而加速动脉粥样硬化的进展?本研究探讨抗β2GPI抗体对apoE基因敲除(apoE-/-)小鼠巨噬细胞摄取功能、ERS以及AS间的关系。
-
6~8周龄雄性apoE-/-小鼠购自北京维通利华实验动物有限公司,饲养于河北省人民医院临研中心SPF级动物房,每笼5只,体质量(19±3)g。人血浆β2GPⅠ、兔多克隆抗人β2GPⅠ抗体及兔多克隆同源对照IgG抗体由河北省人民医院实验室制备;oxLDL购自北京协生生物科技有限公司;IRE1-α、p-IRE1-α、ATF6、GRP-94、CD36、GAPDH抗体均购自Abcam公司;BCA蛋白定量试剂盒、Movat试剂盒购自北京索莱宝生物有限公司;高脂饲料购自宁波鼠一鼠二实验动物饲料有限公司;DAB显色液: 北京中杉金桥公司;HRP标记山羊抗兔抗体: 南京生兴生物技术有限公司;NBD-胆固醇: 美国Sigma公司;RPMI 1640培养基: 美国Gibco公司;胎牛血清: 美国Hyclone公司;硫乙醇酸盐肉汤: 碧迪医疗器械有限公司。
-
石蜡切片机购自Leica公司;酶标仪购自美国Bio-Rad公司;电泳仪及转膜仪购自北京六一仪器厂;超净工作台、恒温培养箱购自赛默飞世尔科技有限公司;显微镜购自德国Leica公司;IVC独立通风系统购自美国Allentown公司。
-
将24只小鼠适应性普通饲料饲养1周后,随机分成模型组和抗β2GPI抗体组,每组8只,模型组腹腔注射0.9%氯化钠溶液稀释后的同源对照IgG抗体,抗β2GPI抗体组腹腔注射抗β2GPI抗体,分均给予高脂饲料喂养,实验周期为8周。余下8只小鼠也用高脂饲料喂养,用于腹腔巨噬细胞的提取。
-
各组小鼠脱颈处死后,快速分离主动脉,留取一部分-80 ℃冻存,用于Western blotting检测,另一部分甲醛固定,常规脱水,石蜡包埋后进行切片,Movat染色,免疫组织化学染色观察主动脉根部斑块的病理形态。切片脱蜡至水,水洗3次,每次5 min,高压修复后水洗3次,每次5 min,加入3%过氧化氢室温30 min,水洗3次,每次5 min,2%牛血清白蛋白(BSA)封闭30 min,加CD68(1∶800)放入湿盒4 ℃过夜,第2天,水洗3次,每次5 min,加入二抗(1∶400)室温50 min,水洗3次,每次5 min,DAB显色,镜下控制显色时间,苏木素染核,水洗,流水冲洗10 min反蓝,晾干封片。
-
将各组小鼠冻存的主动脉根部从-80 ℃冰箱取出,冰上研磨提取蛋白,按照BCA蛋白测定试剂盒说明书操作,SDS-聚丙烯酰胺凝胶电泳分离蛋白,随后转膜,用5% BSA的室温封闭2 h,加入IRE1-α、ATF6、GRP-94、CD36抗体(稀释浓度均为1∶1 000)4 ℃孵育过夜后用TBST在摇床上洗3次,每次15 min,加入相应的二抗,室温孵育2 h,TBST洗后成像拍照。
-
将余下的8只小鼠随机分为抗β2GPI抗体组和模型组,腹腔注射巯基乙酸肉汤2 mL,3 d后脱颈处死,75%乙醇浸泡5 min,无菌打开腹腔,PBS冲洗提取巨噬细胞置于离心管中,1 200 r/min离心5 min,弃上清,加入适量红细胞裂解液,1 200 r/min离心5 min,弃上清,加入RPMI 1640培养基(含20%胎牛血清),吹打混匀,接种于6孔板中,每孔约4×106个细胞,4 h后观察细胞贴壁情况,换液去除未贴壁细胞,培养24 h后,接种于6孔板,PBS洗涤1遍,制作细胞爬片,抗β2GPI抗体组与模型组分别加入oxLDL(50 μg/mL)+抗β2GPI抗体(100 μg/mL)、oxLDL(50 μg/mL)刺激24 h后,PBS洗涤1遍,加入10 μmol/L NBD-胆固醇(绿色荧光)孵育,PBS洗涤2遍,加入DAPI(红色荧光)染核,45 min后,收取细胞爬片进行荧光照相,测定荧光强度,反映巨噬细胞的吞噬功能。
-
制作细胞涂片,加入固定液固定,浸染配制好的油红O工作液中10~15 min,放入60%异丙醇中漂洗20~30 s,流水冲洗,放入蒸馏水稍清洗,苏木素染细胞核1~2 min,自来水冲洗,晾干,封片,显微镜下观察泡沫细胞。
-
采用t检验。
-
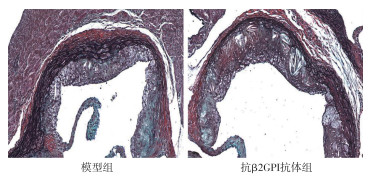
Movat染色显示,抗β2GPI抗体组小鼠主动脉斑块增多,斑块面积较大,胶原纤维、平滑肌纤维含量均减少,与模型组相比差异有统计学意义(P < 0.05~P < 0.01)(见图 1、表 1)。
分组 n 斑块面积/μm2 胶原纤维/μm2 平滑肌纤维/μm2 模型组 8 8 256.32±3 319.60 5 763.98±337.82 5 576.77±268.93 抗β2GPI抗体组 8 10 387.28±2 894.34 3 980.32±436.78 3 265.55±2 238.60 t — 1.37 9.14 2.90 P — < 0.05 < 0.01 < 0.05 表 1 2组主动脉根部斑块面积及成分比较(x±s)
-
免疫组织化学染色显示,抗β2GPI抗体组小鼠主动脉根部斑块巨噬细胞面积为(8 130.59±818.21)μm2,大于模型组的(6 819.85±1 285.10)μm2(t=2.43,P < 0.05)(见图 2)。
-
抗β2GPI抗体组小鼠中ERS通路标志蛋白IRE1-α、p-IRE1-α、ATF6、GRP-94及巨噬细胞CD36蛋白表达量均高于模型组(P < 0.05~ P < 0.01)(见图 3、表 2)。
分组 n IRE1-α p-IRE1-α ATF6 GRP-94 CD36 模型组 8 1.22±0.53 1.01±0.34 1.07±0.62 0.89±0.46 1.00±0.75 抗β2GPI抗体组 8 2.11±0.85 1.48±0.54 1.68±0.52 1.61±0.43 1.71±0.75 t — 2.51 2.08 2.13 3.23 1.89 P — < 0.05 < 0.05 < 0.05 < 0.01 < 0.05 表 2 2组小鼠ERS通路蛋白及CD36蛋白表达量比较(x±s)
-
荧光染色结果显示,抗β2GPI抗体组绿色荧光强度明显强于模型组(P < 0.01);泡沫细胞油红O染色结果显示,抗β2GPI抗体组存在泡沫细胞且数量明显多于模型组(P < 0.01)(见图4、表 3)。
分组 n 绿色荧光强度 泡沫细胞量 模型组 8 100.87±16.15 0.35±0.09 抗β2GPI抗体组 8 131.97±8.94 0.71±0.13 t — 3.36 4.46 P — < 0.01 < 0.01 表 3 2组泡沫细胞胆固醇流出比较(x±s)
-
AS的发生有很多原因,AS也是许多心血管疾病的病理基础。许多研究[10-12]证实,AS的发生发展与慢性炎症和自身免疫反应密切相关。相关研究[11, 13]显示,低密度脂蛋白(low density lipoprotein,LDL)、oxLDL等多种脂质成分参与AS的发展,被认为是AS的独立危险因素。临床研究发现,许多自身免疫性疾病如系统性红斑狼疮、APS等的发生常伴发动脉粥样硬化,或者加速AS的发生,导致较高的发病率和死亡率[14-16]。这些自身免疫性疾病与AS发病机制之间的文献报道表明,β2GPI是APS中最主要的自身抗原,其能与致动脉粥样硬化因子oxLDL结合,形成稳定的oxLDL/β2GPI复合物,促进巨噬细胞摄取oxLDL,转变成泡沫细胞,加速自身免疫介导的动脉粥样硬化进程。相关研究[17]证实oxLDL还可在巨噬细胞衍生泡沫细胞形成过程中诱导ERS,ERS的激活发生在AS病变的各个阶段,因此,本研究展开了对抗β2GPI抗体与apoE-/-小鼠AS的研究。
通过病理组织学染色,本研究观察到高脂饲料喂养的小鼠中,抗β2GPI抗体组小鼠主动脉僵硬,斑块较多,Movat染色显示主动脉斑块形成,且面积增大,胶原纤维、平滑肌纤维含量均减少,而模型组小鼠主动脉斑块较少,胶原纤维、平滑肌纤维含量较多;免疫荧光染色结果观察到抗β2GPI抗体组小鼠主动脉内CD36标记的巨噬细胞浸润数量显著增多,CD36表达量较模型组升高,以上结果显示,抗β2GPI抗体可通过作用于CD36标记的巨噬细胞进而引起或加速病理性AS的形成。AS小鼠体内的巨噬细胞可过多地摄取oxLDL,使其向泡沫细胞转变,沉积在动脉壁,进一步加重血管壁的损伤,加速AS的发展。为进一步证实抗β2GPI抗体是如何影响巨噬细胞进而引起或加速AS的形成,本研究应用体外培养小鼠腹腔巨噬细胞验证体内实验结果,结果显示,抗β2GPI抗体组oxLDL+抗β2GPI抗体刺激引起的巨噬细胞吞噬oxLDL增多并且向泡沫细胞转化强于模型组,即单独oxLDL刺激巨噬细胞,且抗β2GPI抗体组泡沫细胞数量增多,胆固醇流出较少,堆积在巨噬细胞中,泡沫细胞油红O染色显示,抗β2GPI抗体组的泡沫细胞存在并且数量增多,抗β2GPI抗体组oxLDL+抗β2GPI抗体刺激引起的巨噬细胞吞噬oxLDL增多,向泡沫细胞转化增多,且巨噬细胞数量增多。巨噬细胞脂质代谢紊乱,吞噬超负荷脂质,胆固醇流出障碍,使脂质类物质在巨噬细胞中大量堆积形成泡沫细胞,是引起AS进程中至关重要的一步。基于上述研究结果,推测抗β2GPI抗体可与AS的独立危险因素oxLDL结合形成稳定的oxLDL/β2GPI复合物,促进巨噬细胞摄取更多的oxLDL,减弱胆固醇流出的效应,使脂质在巨噬细胞内沉积,促进巨噬细胞向泡沫细胞转变,加速AS的进展。
为了验证巨噬细胞摄取oxLDL向泡沫细胞转变过程中ERS的变化,本研究采用Western blotting检测ERS标志蛋白的表达,结果显示,抗β2GPI抗体组IRE1-α、p-IRE1-α、ATF6、GRP-94小鼠主动脉中表达升高,说明抗β2GPI抗体同时激活了ERS,促使巨噬细胞表面的清道夫受体CD36高表达,巨噬细胞上的清道夫受体已被证明是泡沫细胞形成的关键,巨噬细胞通过表面清道夫受体识别并摄取氧化性低密度脂蛋白,促进泡沫细胞形成,沉积在血管壁,加速AS的发展进程。
综上,抗β2GPI抗体可促进apoE-/-小鼠巨噬细胞摄取oxLDL,加速泡沫细胞的形成,并且通过ERS促进CD36在巨噬细胞中的表达,加速摄取oxLDL,最终引起或加速AS的发展。由于抗β2GPI抗体在AS的各个阶段都起着至关重要的作用,因此降低抗β2GPI抗体的含量可能是调控AS进程的有效方法之一。
抗β2GPI抗体促进巨噬细胞摄取oxLDL加速动脉粥样硬化进展
Anti-β2GPⅠ antibody promotes uptake of oxLDL by macrophages to accelerate the progression of atherosclerosis
-
摘要:
目的研究抗β2糖蛋白Ⅰ(β2GPⅠ)抗体在apoE基因敲除(apoE-/-)小鼠巨噬细胞摄取功能及动脉粥样硬化之间的关系。 方法将雄性apoE-/-小鼠随机分为抗β2GPI抗体组和模型组,每组8只,均给予高脂饲料喂养8周,其中,抗β2GPI抗体组小鼠腹腔注射抗β2GPI抗体,模型组小鼠腹腔注射同等剂量0.9%氯化钠溶液稀释的同源对照IgG抗体。8周后解剖小鼠,分离小鼠主动脉根组织,行Movat染色、免疫组织化学染色,观察主动脉根部动脉粥样硬化斑块的病理组织学特点;Western blotting检测主动脉斑块中内质网应激和巨噬细胞的标志蛋白表达;腹腔巨噬细胞体外培养,抗β2GPI抗体组和模型组分别加入氧化型低密度脂蛋白(oxLDL)+抗β2GPI抗体、oxLDL刺激24 h,观察巨噬细胞摄取oxLDL情况。 结果Movat染色显示,抗β2GPI抗体组小鼠主动脉斑块增多,斑块面积较大,胶原纤维、平滑肌纤维含量均减少,与模型组相比差异有统计学意义(P < 0.05~P < 0.01)。免疫组织化学染色显示,抗β2GPI抗体组小鼠主动脉根部斑块巨噬细胞面积大于模型组(P < 0.05)。Western blotting结果显示,抗β2GPI抗体组小鼠中内质网应激通路标志蛋白IRE1-α、p-IRE1-α、ATF6、GRP-94及巨噬细胞CD36蛋白表达量均高于模型组(P < 0.05~P < 0.01)。荧光染色结果显示,抗β2GPI抗体组绿色荧光强度明显强于模型组(P < 0.01)。泡沫细胞油红O染色结果显示,抗β2GPI抗体组存在泡沫细胞且数量明显多于模型组(P < 0.01)。 结论抗β2GPI抗体促进apoE-/-小鼠巨噬细胞摄取oxLDL,加速泡沫细胞的形成,并且通过内质网应激促进CD36在巨噬细胞中的表达,加速摄取oxLDL,进而促进动脉粥样硬化进展。 Abstract:ObjectiveTo investigate the role of anti-β2-glycoprotein Ⅰ(β2GPⅠ)antibody in the relationship between macrophage uptake and atherosclerosis in apoE knockout (apoE-/-) mice. MethodsThe male apoE-/- mice were randomly divided into the anti-β2GPⅠ antibody group and model group, with 8 mice in each group, and fed with high-fat diet for 8 weeks.The mice in the anti-β2GPⅠ antibody group were intraperitoneally injected with anti-β2GPⅠantibody, and the mice in the model group were intraperitoneally injected with the same dose of homologous control IgG antibody diluted with 0.9% sodium chloride solution.After 8 weeks, the mice were dissected, and the aortic root tissues were isolated for Movat staining and immunohistochemical staining to observe the histopathological characteristics of atherosclerotic plaques in the aortic root; Western blotting was used to detect the expression of marker proteins of endoplasmic reticulum stress and macrophage in aortic plaques; the peritoneal macrophages were cultured in vitro, the anti-β2GPⅠ antibody group and model group were stimulated with oxidized low-density lipoprotein (oxLDL) plus anti-β2GPⅠ antibody and oxLDL for 24 hours, respectively, to observe the uptake of oxLDL by macrophages. ResultsMovat staining showed that the aortic plaque increased, the plaque area was larger, and the contents of collagen fibers and smooth muscle fibers were decreased in the anti-β2GPⅠ antibody group compared with the model group (P < 0.05 to P < 0.01).Immunohistochemical staining indicated that the area of macrophages in the aortic root plaque in the anti-β2GPⅠ antibody group was larger than that in the model group (P < 0.05).The results of Western blotting displayed that the expression levels of marker proteins of endoplasmic reticulum stress pathway such as IRE1-α, p-IRE1-α, ATF6, GRP-94 and macrophage CD36 protein were higher than those in the model group (P < 0.05 to P < 0.01).The results of fluorescence staining showed that the green fluorescence intensity in the anti-β2GPⅠ antibody group was significantly stronger than that in model group (P < 0.01).The results of oil red O staining of foam cells showed that foam cells existed in the anti-β2GPⅠ antibody group and the number of foam cells was significantly higher than that in the model group (P < 0.01). ConclusionsThe anti-β2GPⅠ antibody promotes the uptake of oxLDL by macrophages in apoE-/- mice, accelerates the formation of foam cells, and increases the expression of CD36 in macrophages through endoplasmic reticulum stress to accelerate the uptake of oxLDL, thus promoting the progression of atherosclerosis. -
Key words:
- atherosclerosis /
- anti-β2-glycoprotein Ⅰ antibody /
- macrophage
-
表 1 2组主动脉根部斑块面积及成分比较(x±s)
分组 n 斑块面积/μm2 胶原纤维/μm2 平滑肌纤维/μm2 模型组 8 8 256.32±3 319.60 5 763.98±337.82 5 576.77±268.93 抗β2GPI抗体组 8 10 387.28±2 894.34 3 980.32±436.78 3 265.55±2 238.60 t — 1.37 9.14 2.90 P — < 0.05 < 0.01 < 0.05 表 2 2组小鼠ERS通路蛋白及CD36蛋白表达量比较(x±s)
分组 n IRE1-α p-IRE1-α ATF6 GRP-94 CD36 模型组 8 1.22±0.53 1.01±0.34 1.07±0.62 0.89±0.46 1.00±0.75 抗β2GPI抗体组 8 2.11±0.85 1.48±0.54 1.68±0.52 1.61±0.43 1.71±0.75 t — 2.51 2.08 2.13 3.23 1.89 P — < 0.05 < 0.05 < 0.05 < 0.01 < 0.05 表 3 2组泡沫细胞胆固醇流出比较(x±s)
分组 n 绿色荧光强度 泡沫细胞量 模型组 8 100.87±16.15 0.35±0.09 抗β2GPI抗体组 8 131.97±8.94 0.71±0.13 t — 3.36 4.46 P — < 0.01 < 0.01 -
[1] ZHANG GT, CAI QQ, ZHOU H, et al. OxLDL/β2GPI/antiβ2GPI Ab complex induces inflammatory activation via the TLR4/NFκB pathway in HUVECs[J]. Molecular Medicine Reports, 2020, 23(2): 148. doi: 10.3892/mmr.2020.11787 [2] OUYANG H, ZHOU H, CHAO HE, et al. The oxLDL/β2GPI/anti-β2GPI antibody complex promotes A7r5 chemotaxis, migration and lipid accumulation[J]. Chin J Cell Mol Imm, 2018, 33(12): 1622. [3] SIAMON G, MARTINEZ FO. Alternative activation of macrophages: mechanism and functions[J]. Immunity, 2010, 32(5): 593. doi: 10.1016/j.immuni.2010.05.007 [4] 黄影, 朱丽华. 巨噬细胞在动脉粥样硬化中作用的研究进展[J]. 实用心脑肺血管病杂志, 2017, 5(5): 6. [5] BLIDEN KP, CHAUDHARY R, LOPEZ LUIS R, et al. Oxidized low-density lipoprotein-β 2-glycoprotein I complex but not free oxidized LDL is associated with the presence and severity of coronary artery disease[J]. Am J Cardiol, 2016, 118(5): 673. doi: 10.1016/j.amjcard.2016.06.023 [6] SHUBHANGINI T, SINGH S. Reciprocal upshot of nitric oxide, endoplasmic reticulum stress, and ubiquitin proteasome system in Parkinson's disease pathology[J]. Neuroscientist, 2020, 27(4): 340. [7] 史晓燕, 李京涛. 内质网应激及其对肝纤维化调控作用的研究进展[J]. 中华肝脏病杂志, 2018, 26(11): 865. doi: 10.3760/cma.j.issn.1007-3418.2018.11.013 [8] PASQUALE ED, Condorelli G, PASQUALE, CHEVET E. Endoplasmic reticulum stress at the crossroads of progeria and atherosclerosis[J]. Embo Molecular Medicine, 2019, 11(4): e10360. [9] LARA-GUZMAN OJ, GIL-IZQUIERDO A, MEDINA S, et al. Oxidized LDL triggers changes in oxidative stress and inflammatory biomarkers in human macrophages[J]. Redox Biol, 2018, 15(1): 11. [10] ZHOU AX, TABAS IRA. The UPR in atherosclerosis[J]. Semin Immunopathol, 2013, 35(3): 321. doi: 10.1007/s00281-013-0372-x [11] YANG X, YIN M, YU L, et al. Simivastatin inhibited oxLDL-induced proatherogenic effects through calpain-1/PPARγ/CD36 pathway[J]. Can J Physiol Pharmacol, 2016, 94(12): 1. [12] WEINSTOCK A, FISHER EA. Methods to study monocyte and macrophage trafficking in atherosclerosis progression and resolution[J]. Methods Mol Biol, 2019, 1951: 153. [13] WANG D, YANG Y, LEI Y, et al. Targeting foam cell formation in atherosclerosis: therapeutic potential of natural products[J]. Pharmacol Rev, 2019, 71(4): 596. doi: 10.1124/pr.118.017178 [14] HERNANDEZ-TRUJILLO Y, RODRIGUEZ-ESPARRAGON F, MACIAS-RERES A, et al. Rosiglitazone but not losartan prevents Nrf-2 dependent CD36 gene expression up-regulation in an in vivo atherosclerosis model[J]. Cardiovascular Diabetology, 2008, 7(1): 3. [15] 胥亚. TLR4/NF-κB通路在oxLDL/β2GPI/anti-β2GPI复合物诱导小鼠巨噬细胞泡沫化中的作用探讨[D]. 镇江: 江苏大学, 2014. [16] ZHANG P, ZHOU H, HE C, et al. OxLDL/β2GPⅠ/β2GPⅠ-Ab complex in regulating the phenotypic transformation of A7r5 and the expression of lipid transporters[J]. Chin J Clin Lab Sci, 2019, 37(3): 195. [17] 杨金伟, 赵灿, 刘秀, 等. 左归降糖舒心方含药血浆对ox-LDL诱导小鼠巨噬细胞泡沫化和凋亡的影响[J]. 南京中医药大学学报, 2020, 36(3): 96. -





 下载:
下载: