-
乳腺癌是一种多发于女性人群的恶性肿瘤,且发病率较高,大约每10万女性中就有42人患有此病[1]。前哨淋巴结转移是淋巴结转移的第一站,也是乳腺癌最早出现的一种肿瘤细胞扩散形态。同时,恶性肿瘤的侵袭性、机体对肿瘤的抵抗力均可通过淋巴结的状态来反映。此外,临床肿瘤分期、手术方法、辅助治疗等均需以淋巴结的状态作为参考依据。乳腺癌前哨淋巴结活检术是乳腺外科医学史上非常重大的一次突破,目前已逐渐在临床获得广泛应用与认可[2]。荧光染料法、蓝染料法及放射性核素法是三种常见的乳腺癌前哨淋巴结活检示踪法,但上述方法均为有创操作,再加上淋巴结穿刺具有一定难度,其诊断的准确度并不高[3]。随着近年超声造影技术的不断发展,逐渐体现出其操作简单、无污染、无创、实时等独特优势,为前哨淋巴结性质判断及活检术的定位提供了全新途径[4]。为了进一步明确术前超声造影对乳腺癌前哨淋巴结转移的预测价值,我们开展了此次研究。现作报道。
-
选择2017年7月至2019年7月我院收治的乳腺癌病人276例。纳入标准: (1)女性;(2)单侧单发肿块;(3)行超声造影及前哨淋巴结活检术;(4)符合乳腺癌诊断标准[5],并经病理诊断为乳腺癌;(5)既往未进行过乳腺/腋窝手术;(6)病人知情同意,并签署知情同意书。排除标准: (1)常规超声或病理确诊为腋窝淋巴结阳性者;(2)炎性乳腺癌者;(3)无腋窝手术计划者;(4)对超声造影剂过敏者。病人年龄34~69岁;绝经92例,未绝经184例。
-
采用西门子Acuson S2000型彩色多普勒超声诊断仪,具有高分辨力高频线阵探头,采用反向脉冲造影成像,机械指数为0.06,适当调整造影增益、时间增益补偿及深度,尽可能避免对微泡造成破坏。仪器自带硬盘可自动存储采集到的动态造影数据。
操作方法: 病人仰卧,将患侧上肢外旋外展,常规超声探查并确认可能存在前哨淋巴结的部位,造影前采用二维超声探查患侧腋窝淋巴结以了解淋巴结形态、大小、血流分布及内部回声等。将声诺维造影剂(意大利Bracco公司)用5 mL 0.9%氯化钠溶液充分震荡溶解成微泡悬液,对患侧乳晕区进行麻醉后,用5 mL注射器取2 mL微泡悬液皮下注射于乳晕周围3、6、9、12点钟方向(每方向0.5 mL),完成注射后轻轻给予10~15 s按摩,促使造影剂更快到达淋巴管。将CPS造影系统开启,用超声探头实时动态查看淋巴结和淋巴管的造影显像情况,标记好第一组(或第一个)增强显影的淋巴结(前哨淋巴结)。如果淋巴管不显影或显影模糊,应在常规部位反复查找可疑淋巴结并进行标记;如果造影过程中微泡消失,可再注射一次微泡悬液,并再次仔细探查原标记的前哨淋巴结周围是否还有增强淋巴结,避免出现漏检。最后通过常规超声对前哨淋巴结的大小进行测量及标记。
-
给予气管插管全身麻醉,病人取仰卧位,上肢外展90°,垫高患侧肩部,常规消毒、铺巾。在腋折线稍下方胸大肌外侧缘区作一个3~4 cm的弧形(或斜形)切口,将皮肤及皮下组织逐层切开并分离,在体表标记部位沿着增强淋巴管找到相应淋巴结,对该淋巴结形态及位置进行查看,测量其大小,并与术前造影对比判断是否为相同淋巴结。使用快速病理对切除的淋巴结进行诊断,并按照病理学检查结果决定是否给予腋窝淋巴结清扫。
-
由两名高年资超声科医生操作超声仪器与判读结果,并判断前哨淋巴结的增强类型,其中未出现淋巴结转移为Ⅰ型,考虑淋巴结转移为Ⅱ、Ⅲ型[6];以病理学检查结果作为判断有无前哨淋巴结转移的金标准,并将病理学检查结果和超声造影结果进行对比。对超声造影敏感性、特异性、阳性预测值、阴性预测值及准确率等进行计算[7-8]。
-
276例病人中,124例肿瘤位置在左乳,152例位置在右乳;100例肿瘤部位在外上象限,47例在外下象限,60例在内上象限,69例在内下象限;所有病人均经病理证实为原发性乳腺癌,其中183例为浸润性导管癌,65例为导管内原位癌,16例为黏液癌,12例为其他;原发肿瘤直径0.60~4.9 cm;前哨淋巴结直径0.3~3.2 cm。
-
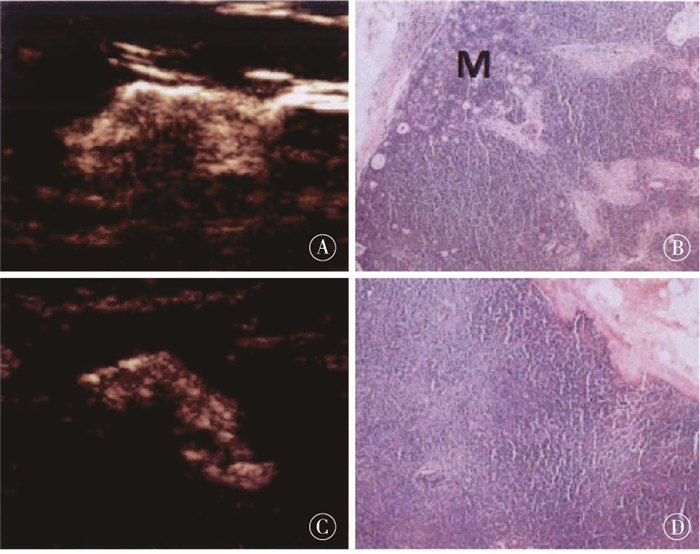
术前超声造影共检出497枚前哨淋巴结,手术共切除518枚前哨淋巴结,术前超声造影对前哨淋巴结的检出率为95.95%(497/518),病理学检查确认存在120枚转移前哨淋巴结。术前超声造影预测前哨淋巴结阳性的病人73例,阴性病人203例(见表 1),其中术前超声造影对有无前哨淋巴结的预测灵敏性76.12%(51/67),特异性89.47%(187/209),阳性预测值69.86%(51/73),阴性预测值92.12%(187/203),准确率86.23%(238/276)。典型超声造影阳性(Ⅱ型、Ⅲ型增强)与病理结果对比见图 1、2。
超声造影 病理结果 合计 阳性 阴性 阳性 51 22 73 阴性 16 187 203 合计 67 209 276 表 1 前哨淋巴结超声造影结果与病理结果对比(n)
-
随着每年乳腺癌发病人数持续升高及各种手术方法的临床应用,对超声诊断前哨淋巴结的技术要求也越来越高[9-10]。因为乳腺癌转移过程中是先通过淋巴道而非先通过血道,且基本上均为腋窝淋巴结转移,所以准确找到前哨淋巴结的位置及评价腋窝淋巴结是否恶性,对病人的治疗具有非常重要的意义。腋窝淋巴结的位置、大小、结构及形态均可通过常规超声检查正确判断,与彩色超声血流显像相结合后,淋巴结良恶性大都可以准确辨别。不过前哨淋巴通道及引流路径并不能通过常规超声探查到,且无法对前哨淋巴结的位置及数量进行正确判断,常规超声存在的各种弊端尚需寻找更加有效的方法来弥补[11-12]。
目前,临床中蓝染及放射性同位素是用于寻找前哨淋巴结的常用方法,两者联合后对前哨淋巴结的定位率可达到96%,假阴性率可低至5%[13]。虽然效果好,但也存在一些缺陷及问题: (1)蓝染法对组织的穿透力不佳,寻找前哨淋巴结的难度较高,需由经验丰富的医生完成;(2)蓝染法容易引起过敏,甚至注射位置组织坏死等;(3)放射性同位素操作难度大,且难以降解,容易导致医源性污染;(4)放射性同位素标记的硫胶体、血浆蛋白等小分子物质容易向第二级淋巴结侵袭,导致淋巴结标记个数超过真实的前哨淋巴结个数。鉴于以上缺陷及问题,临床开始研究一些其他的前哨淋巴结检出方式,比如超顺磁性纳米颗粒、吲哚箐绿荧光染色及超声造影等,均取得了一定效果。
而前哨淋巴结的超声造影,是将造影剂皮下注射于乳晕四周后,再采用超声对增强淋巴结及显影淋巴管进行实时动态探查。造影剂一般采用平均直径2.5 μm的六氧化硫微泡,比红细胞直径(7.5 μm)小三倍左右,所以微泡可以在淋巴管、血管甚至肺泡上皮内自由通行,机体更容易将其清除。同时,微泡内没有蛋白及碘成分存在,机体不易对造影剂产生过敏,安全性较高[6]。此外,因为毛细淋巴管由单细胞层的内皮细胞构成,没有平滑肌,且排列重叠而疏松,有利于造影剂的快速通过并进入淋巴管,此后沿着乳腺淋巴引流途径前进,最终顺利抵达前哨淋巴结。将超声造影和前述方法比较,操作更简单,安全性及准确性更高,且可重复性及经济性更好。
本研究证实, 超声造影在前哨淋巴结定位及预测转移方面临床应用价值较高,与相关文献[14-15]报道基本相似。此外,国外学者GOLDBERG等[16]在一项针对猪的实验研究证实,超声造影对前哨淋巴结良恶性具有较高的鉴别价值;GELB等[17]研究也证实,借助淋巴内皮细胞间隙的胞吐或胞饮作用,可将造影剂吸收并停留在前哨淋巴结中,避免其侵入下一级淋巴结,一定程度保证了前哨淋巴结的检出率。但即便这样,还是难以避免会存在较高的假阴性情况。本研究术前超声造影对乳腺癌前哨淋巴结转移诊断的假阴性率较同类研究[18]偏高,可能受到以下几方面原因影响: (1)前哨淋巴结转移具体可以分成单细胞转移、微转移以及宏转移三种,有些单细胞转移及微转移的乳腺癌病人淋巴结解剖学结构并未出现明显变化,因此通过超声造影观察淋巴结形态、血流灌注等情况时很难发觉异常;(2)前哨淋巴结出现宏转移会阻塞淋巴管,造影剂不能顺利抵达前哨淋巴结,但其能够在旁路交通支的作用下进入正常淋巴结,所以容易将最先显影的淋巴结判断为前哨淋巴结,最终导致漏诊;(3)有一些未被恶性肿瘤侵袭的前哨淋巴结超声造影也会有不均匀增强表现,具体机制尚未明确,笔者分析应该与淋巴结结构及淋巴回流有关。研究[19]报道,有部分前哨淋巴结病理学表现为淋巴窦增殖或淋巴滤泡,淋巴细胞异常增殖、分化,以及淋巴阻塞,这些原因都可能导致超声造影不均匀增强。超声造影剂通过淋巴管达到淋巴结后,还会顺着淋巴小叶中被膜下淋巴窦浸入整个淋巴结,本研究在前哨淋巴结中发现了扩张的淋巴窦,因此笔者分析显影偏慢及不均匀增强表现的原因也可能与该区域有关。所以,若术前超声造影下前哨淋巴结呈不均匀增强表现,则转移与未转移均有可能,仅凭借增强模式并不能正确预测前哨淋巴结的转移情况。此外,胡慧等[20]研究发现,超声造影结合亚甲蓝定位能够提高前哨淋巴结活检成功率、敏感性、特异性及准确率(分别为91.2%、93.3%、100%及96.8%)。所以以目前的技术水平来看,超声造影还需联合其他示踪方式对乳腺癌前哨淋巴结转移情况进行预测,才能获得最佳的效果。
术前超声造影对乳腺癌前哨淋巴结转移的预测价值
Predictive value of preoperative contrast-enhanced ultrasound in sentinel lymph node metastasis of breast cancer
-
摘要:
目的分析术前超声造影对乳腺癌前哨淋巴结转移的预测价值。 方法选择乳腺癌病人276例,术前均行超声造影检查寻找前哨淋巴结,将病理学检查结果和超声造影结果进行对比,计算超声造影敏感性、特异性、阳性预测值、阴性预测值及准确率。 结果276例病人中,124例肿瘤位于左乳,152例位于右乳;100例肿瘤部位在外上象限,47例在外下象限,60例在内上象限,69例在内下象限;所有病人均经病理证实为原发性乳腺癌,其中183例为浸润性导管癌,65例为导管内原位癌,16例为黏液癌,12例为其他;原发肿瘤直径0.6~4.9 cm,前哨淋巴结直径0.3~3.2 cm。术前超声造影共检出497枚前哨淋巴结,手术共切除518枚前哨淋巴结,术前超声造影对前哨淋巴结的检出率为95.95%(497/518);病理学检查确认存在120枚转移前哨淋巴结。术前超声造影预测前哨淋巴结阳性病人73例,阴性病人203例,其对有无前哨淋巴结的预测灵敏性76.12%,特异性89.47%,阳性预测值69.86%,阴性预测值92.12%,准确率86.23%。 结论术前超声造影还需联合其他示踪方式对乳腺癌前哨淋巴结转移情况进行预测,才能获得最佳效果。 Abstract:ObjectiveTo analyze the predictive value of preoperative contrast-enhanced ultrasound in sentinel lymph node metastasis of breast cancer. MethodsThe contrast-enhanced ultrasound in 276 patients with breast cancer were performed to find sentinel lymph nodes.The results between pathological examination and contrast-enhanced ultrasound were compared.The sensitivity, specificity, positive predictive value, negative predictive value and accuracy of contrast-enhanced ultrasound in all cases were calculated. ResultsOf the 276 patients, 124 tumors were located in the left breast and 152 tumors were located in the right breast.There were 100 cases in the outer upper quadrant, 47 cases in the outer lower quadrant, 60 cases in the inner upper quadrant and 69 cases in the inner lower quadrant.All patients were pathologically confirmed as primary breast cancer, which included 183 cases of invasive ductal carcinoma, 65 cases of intraductal carcinoma in situ, 16 cases of mucinous carcinoma and 12 cases of other cancers.The diameter of the primary tumor was 0.6-4.9 cm, and the diameter of the sentinel lymph node was 0.3-3.2 cm.A total of 497 sentinel lymph nodes were detected by preoperative contrast-enhanced ultrasound, and a total of 518 sentinel lymph nodes were removed by operation.The detection rate of preoperative contrast-enhanced ultrasound of sentinel lymph nodes was 95.95%(497/518).The results of pathological examination confirmed that 120 nodes were metastatic sentinel nodes.Seventy-three patients with positive and 203 patients with negative sentinel lymph nodes were predicted using the preoperative contrast-enhanced ultrasound.The sensitivity, specificity, positive predictive value, negative predictive value and accuracy of predicting sentinel lymph nodes were 76.12%, 89.47%, 69.86%, 92.12% and 86.23%, respectively. ConclusionsIn order to get the best predicting results in the sentinel lymph node metastasis of breast cancer, the contrast-enhanced ultrasound should be combined with other tracing methods. -
Key words:
- breast neoplasms /
- ultrasonic contrast /
- sentinel lymph node
-
表 1 前哨淋巴结超声造影结果与病理结果对比(n)
超声造影 病理结果 合计 阳性 阴性 阳性 51 22 73 阴性 16 187 203 合计 67 209 276 -
[1] 袁蕙芸, 蒋宇飞, 谭玉婷, 等. 全球癌症发病与死亡流行现状和变化趋势[J]. 肿瘤防治研究, 2021, 48(6): 642. doi: 10.3971/j.issn.1000-8578.2021.20.1533 [2] 方静, 张海. 超声评估乳腺癌腋窝淋巴结状态的研究进展[J]. 医学综述, 2018, 24(3): 591. doi: 10.3969/j.issn.1006-2084.2018.03.034 [3] 张文岳, 罗葆明. 超声造影诊断乳腺癌的研究进展[J]. 中国医学影像技术, 2016, 32(9): 1449. doi: 10.13929/j.1003-3289.2016.09.033 [4] 赵婧. 经皮内超声造影对乳腺癌前哨淋巴结的诊断价值[D]. 北京: 北京协和医学院, 2017. [5] 中国抗癌协会乳腺癌专业委员会. 中国抗癌协会乳腺癌诊治指南与规范(2017年版)[J]. 中国癌症杂志, 2017, 27(9): 695. doi: 10.19401/j.cnki.1007-3639.2017.09.004 [6] 赫捷, 陈万青, 李霓, 等. 中国前列腺癌筛查与早诊早治指南(2022, 北京)[J]. 中华肿瘤杂志, 2022, 44(1): 29. [7] 崔岩. 超声造影在乳腺癌诊断及疗效评估中的应用研究[D]. 广州: 南方医科大学, 2016. [8] 韩振中. 基于X线图像的乳腺肿块检测与分类方法研究[D]. 北京: 北京交通大学, 2015. [9] SHIMAZU K, ITO T, UJI K, et al. Identification of sentinel lymph nodes by contrast-enhanced ultrasonography with Sonazoid in patients with breast cancer: a feasibility study in three hospitals[J]. Cancer Med, 2017, 6(8): 1915. doi: 10.1002/cam4.1142 [10] ESFEHANI MH, YAZDANKHAH-KENARI A, OMRANIPOUR R, et al. Validation of contrast enhanced ultrasound technique to wire localization of sentinel lymph node in patients with early breast cancer[J]. Indian J Surg Oncol, 2015, 6(4): 370. doi: 10.1007/s13193-015-0446-4 [11] ECANOW JS, ABE H, NEWSTEAD GM, et al. Axillary staging of breast cancer: what the radiologist should know[J]. Radiographics, 2013, 33(6): 1589. doi: 10.1148/rg.336125060 [12] 李艺, 王燕, 常婷, 等. 经皮超声造影对乳腺癌腋窝前哨淋巴结良恶性鉴别诊断的价值[J]. 中国超声医学杂志, 2015, 31(6): 546. [13] XIE F, ZHANG D, CHENG L, et al. Intradermal microbubbles and contrast-enhanced ultrasound(CEUS)is a feasible approach for sentinel lymph node identification in early-stage breast cancer[J]. World J Surg Onco1, 2015, 13(1): 319. doi: 10.1186/s12957-015-0736-x [14] 彭雪强, 张浩, 卞丽霞. 超声造影对早期乳腺癌腋窝评估可行性的研究[J]. 癌症进展, 2017, 15(4): 447. [15] 马克敏, 徐梅玉. 超声造影对早期乳腺癌前哨淋巴结的诊断价值[J]. 中华实用诊断与治疗杂志, 2018, 32(10): 1013. [16] GOLDBERG BB, MERTON DA, LIU JB, et al. Sentinel lymph nodes in a swine model with melanoma: contrast-enhanced lymphatic[J]. Radiology, 2004, 230(3): 727. [17] GELB HR, FREEMAN IJ, ROHLEDER JJ, et al. Feasibility of contrast-enhanced ultrasound-guided biopsy of sentinel lymph node in dogs[J]. Vet Radiol Ultrasound, 2010, 51(6): 628. [18] 付明刚, 梁挺, 高军喜, 等. 超声造影在乳腺癌前哨淋巴结活检中价值[J]. 中华实用诊断与治疗杂志, 2015, 29(10): 986. [19] WANG Y, CHENG Z, LI J, et al. Gray-scale contrast-enhanced ultrasonography in detecting sentinel lymph nodes: an animal study[J]. Eur J Radio1, 2010, 74(3): e55. [20] 胡慧, 韦伟, 孙德胜, 等. 超声造影结合亚甲蓝定位在乳腺癌前哨淋巴结活检中的应用[J]. 中华医学杂志, 2013, 93(16): 1255. -





 下载:
下载: